胸腺癌(胸腺癌的存活率有多高)
本研究显示,胸腺瘤具有低频率的基因变异(平均1.8/肿瘤)和低水平的TMB。超过10%的胸腺瘤病例中发现的基因变异位于CDKN2A/B和TP53基因。在一例不能切除的III期B3型胸腺瘤中发现NTRK1扩增。胸腺癌基因变异频率为平均4.0/肿瘤,与胸腺瘤相比显著更高(P< .0001),在CDKN2A、KIT和PTEN/PI3K/MTOR通路中观察到临床相关的基因变异。胸腺癌中TMB升高并不常见,只有6%的病例TMB≥10 mut/Mb。
研究背景
胸腺恶性肿瘤代表了一组异质的罕见胸癌,WHO组织病理学分类将其分为胸腺瘤和胸腺癌。根据非肿瘤淋巴细胞成分的相对比例以及与正常胸腺结构的相似性,胸腺瘤进一步细分为不同的类型(即A、AB、B1、B2和B3)。胸腺癌与胸腺外癌相似,最常见的亚型是鳞状细胞癌。从临床角度来看,胸腺瘤通常是具有局部进展而不是转移趋势的肿瘤,相比之下,胸腺癌转移扩散的风险很高。
手术是主要的胸腺恶性肿瘤根治性治疗,因为完全切除是对总生存期最有利的预后因素。同时,高达30%-50%的患者可能出现晚期、复发、转移或难治性肿瘤,需要系统治疗。目前,系统治疗主要为化疗,使大多数患者获得了疾病控制,但反应和无进展生存率有限,尤其是在后线治疗中。
胸腺上皮肿瘤的罕见性导致无法通过大型随机试验来评估创新治疗药物。然而,全基因组谱图(CGP)可能是一个有效选择,通过识别预测性生物标志物来开发精准治疗方案,以满足难治性胸腺上皮肿瘤更有效治疗方案的需求。下一代测序(NGS)可对大量基因变异(GA)进行基因分型。此外,NGS可检测肿瘤突变负荷(TMB),这有助于评估免疫检查点抑制剂的获益风险比。
本研究包括一组多中心、大型系列、晚期难治性胸腺上皮肿瘤,在常规的临床实践环境中对其进行全基因组图谱分析,使用NGS平台进行基因分型。本研究结果提供了胸腺癌致癌驱动分子途径的独特见解,并为使用靶向药物和免疫检查点抑制剂提供了理论基础。
研究结果

临床病理特征:
共分析胸腺瘤90例,胸腺癌174例,根据开展CGP的前提,所有病例必须是临床晚期且对复发性疾病的标准治疗不敏感。表1总结了患者的特征。对于CGP,考虑到GA发生率较低,根据既往报道将90例胸腺瘤分为两组:第一组(n=61)胸腺瘤由A型(n=2)、AB型(n=17)、B1型(n=16)和B2型(n=26)组成,由于肿瘤细胞异型性罕见、诊断时分期较早和生存期较长,被认为是低分级;第二组(n=29)为B3型胸腺瘤,由于存在显著的肿瘤细胞异型性且常表现为侵袭性,被认为是中等分级。
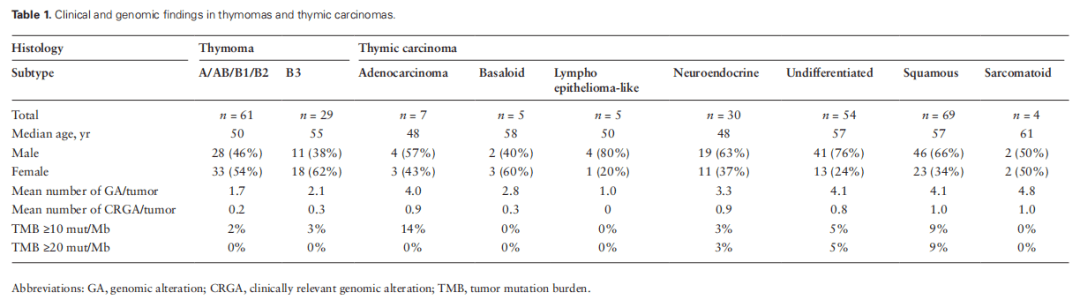
表1
胸腺癌,鉴于文献中关于分级的数据有限,研究者根据组织学亚型进行了分析:鳞状细胞癌(n=69,40%)、非神经内分泌未分化癌(n=54,31%)、神经内分泌癌(n=30,17%)、腺癌(n=7,4%)、基底样癌(n=5,3%)、淋巴上皮样癌(n=5,3%)和肉瘤样癌(n=4,2%)。
胸腺瘤的全基因组分析:
总体而言,胸腺瘤的GA、CRGA(临床相关基因变异)频率较低,TMB水平较低。与A/AB/B1/B2型胸腺瘤相比,B3型胸腺瘤GA、CRGA的平均发生率略高(P=N.S.;表1)。在超过10%的病例中发现的GA位于CDKN2A/B和TP53基因中(图1A和1B)。在不到5%的病例中观察到CRGA,主要是MTOR通路上的PIK3CA、PTEN和NF1基因发生变异。在一例无法切除的III期B3型胸腺瘤中发现了潜在可靶向的NTRK1扩增。在另一例转移到肝脏的B3型胸腺瘤中发现了KIT基因Y823D突变,但该变异与靶向KIT激活突变的激酶抑制剂的耐药性相关。所有病例均为MSI稳定。仅在2%的胸腺瘤中检测到TMB≥10 mut/Mb,没有发现TMB≥20 mut/Mb的胸腺瘤。
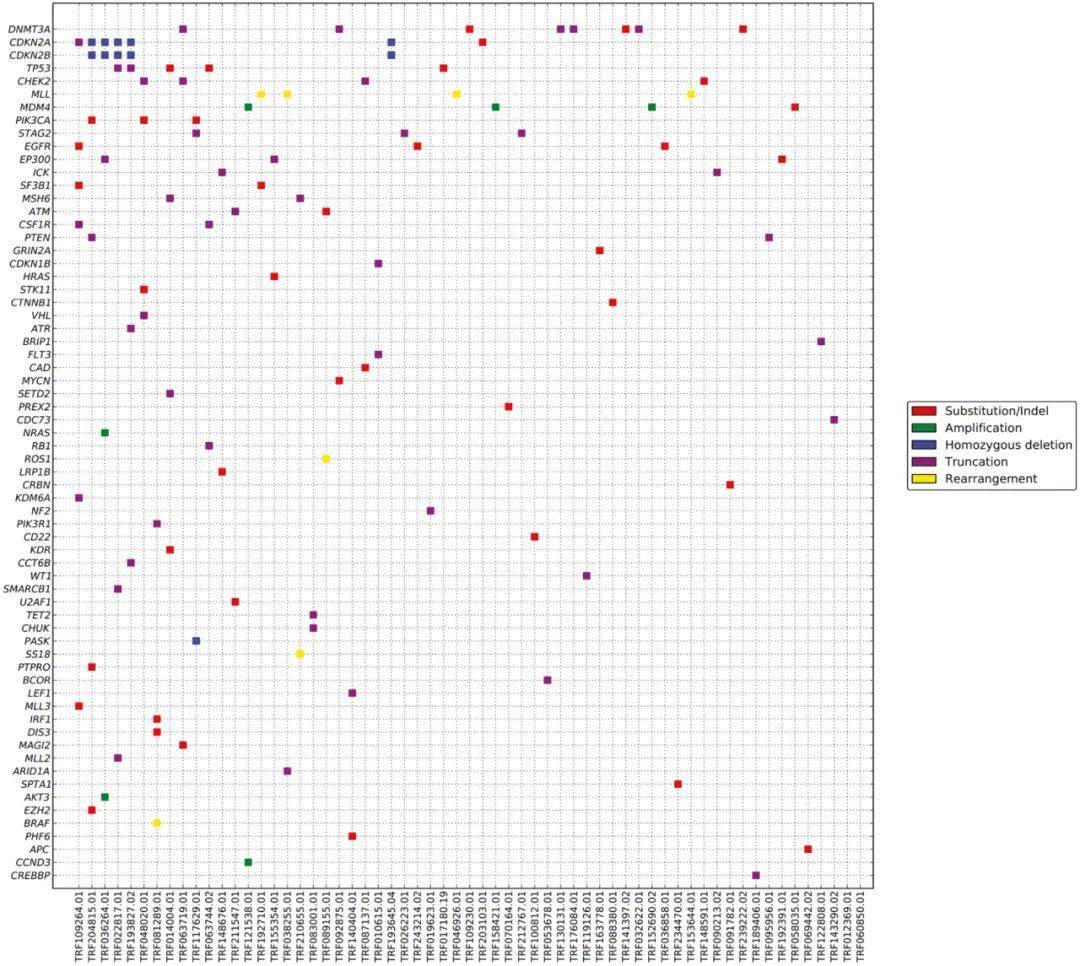
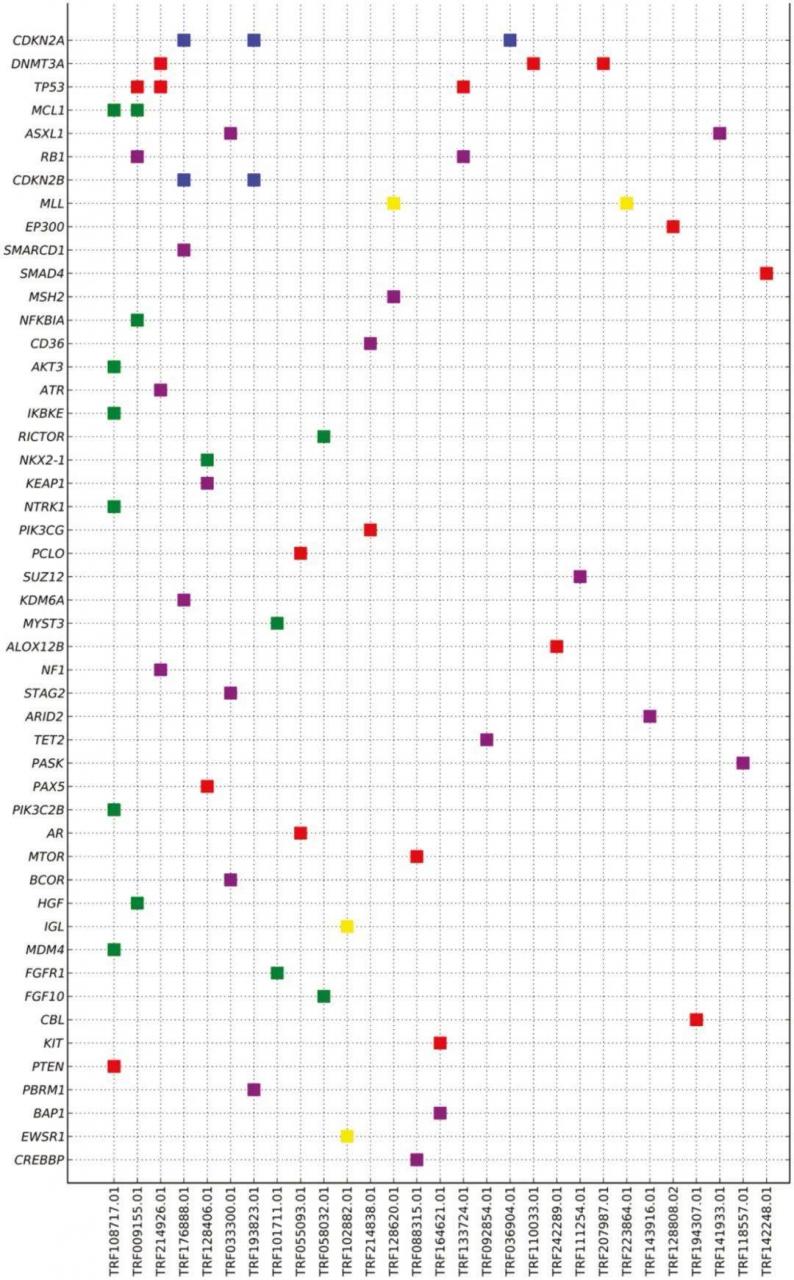
图1
胸腺癌的全基因组分析:
整体而言,胸腺癌组的GA发生率显著高于胸腺瘤组,为4.0/肿瘤,而胸腺瘤组为1.8/肿瘤(P< .0001),且胸腺癌组的CRGA显著高于胸腺瘤组(0.9/肿瘤vs 0.2/肿瘤,P< .0001)。GA与细胞周期、增殖和生存、氧化应激和转录通路控制的失调相关(图2A)。CRGA在CDKN2A、KIT和PTEN/PI3K/MTOR通路中最为常见,其他CRGA发生在EZH2、MET、FGFR3和ERBB2/3基因中。胸腺癌的中位TMB为3.84 mut/Mb,显著高于胸腺瘤的1.92 mut/Mb(P< .0001)。高水平的TMB在胸腺癌中并不常见,只有6%的病例TMB为≥10 mut/Mb,只有3%的病例TMB为≥20 mut/Mb(表1)。所有胸腺癌病例均为MSI稳定。
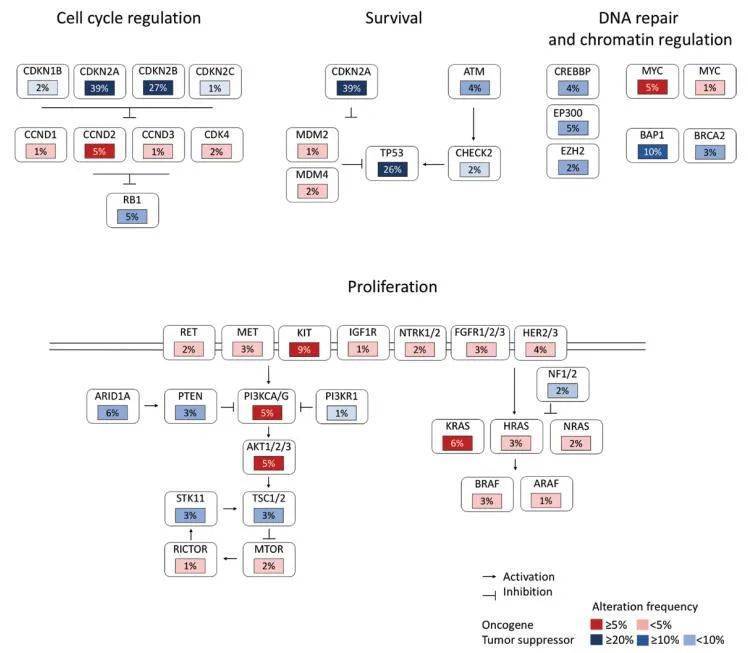
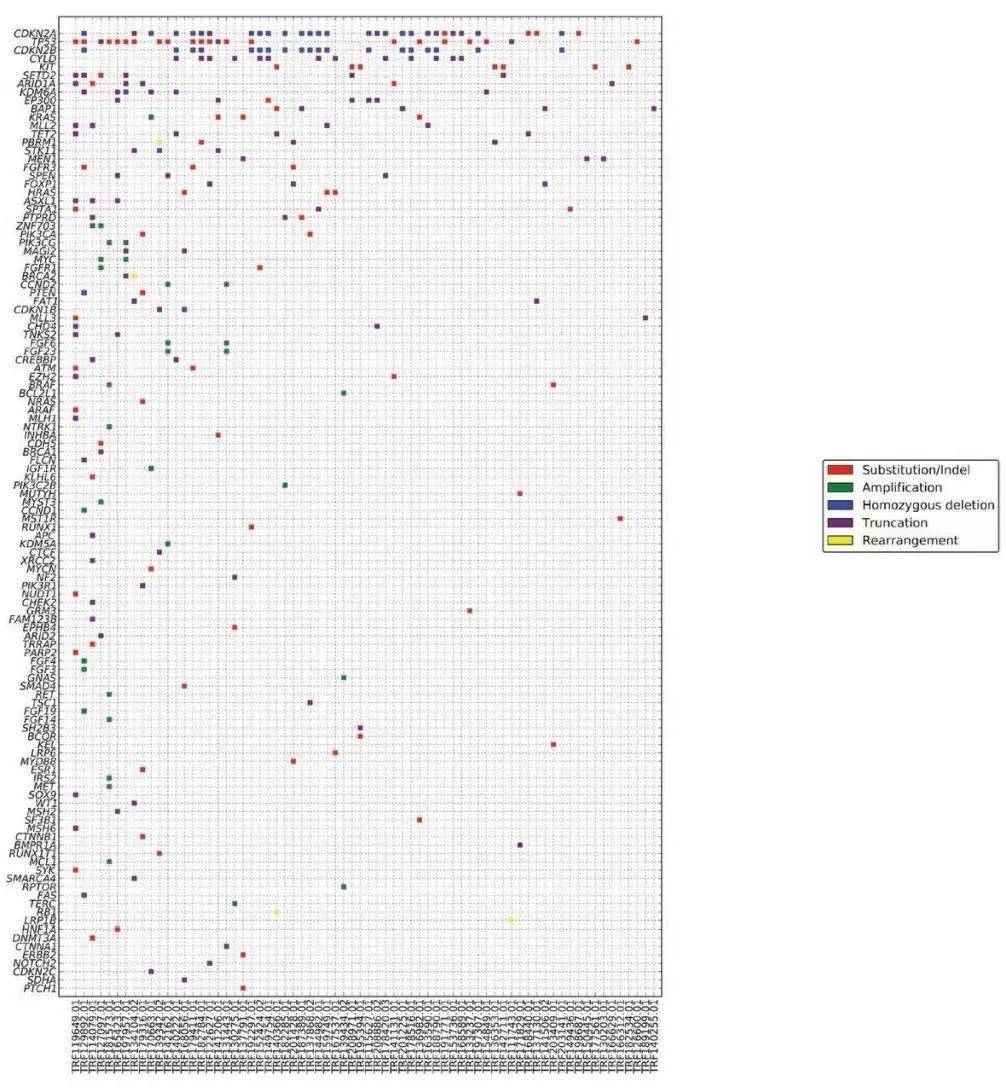
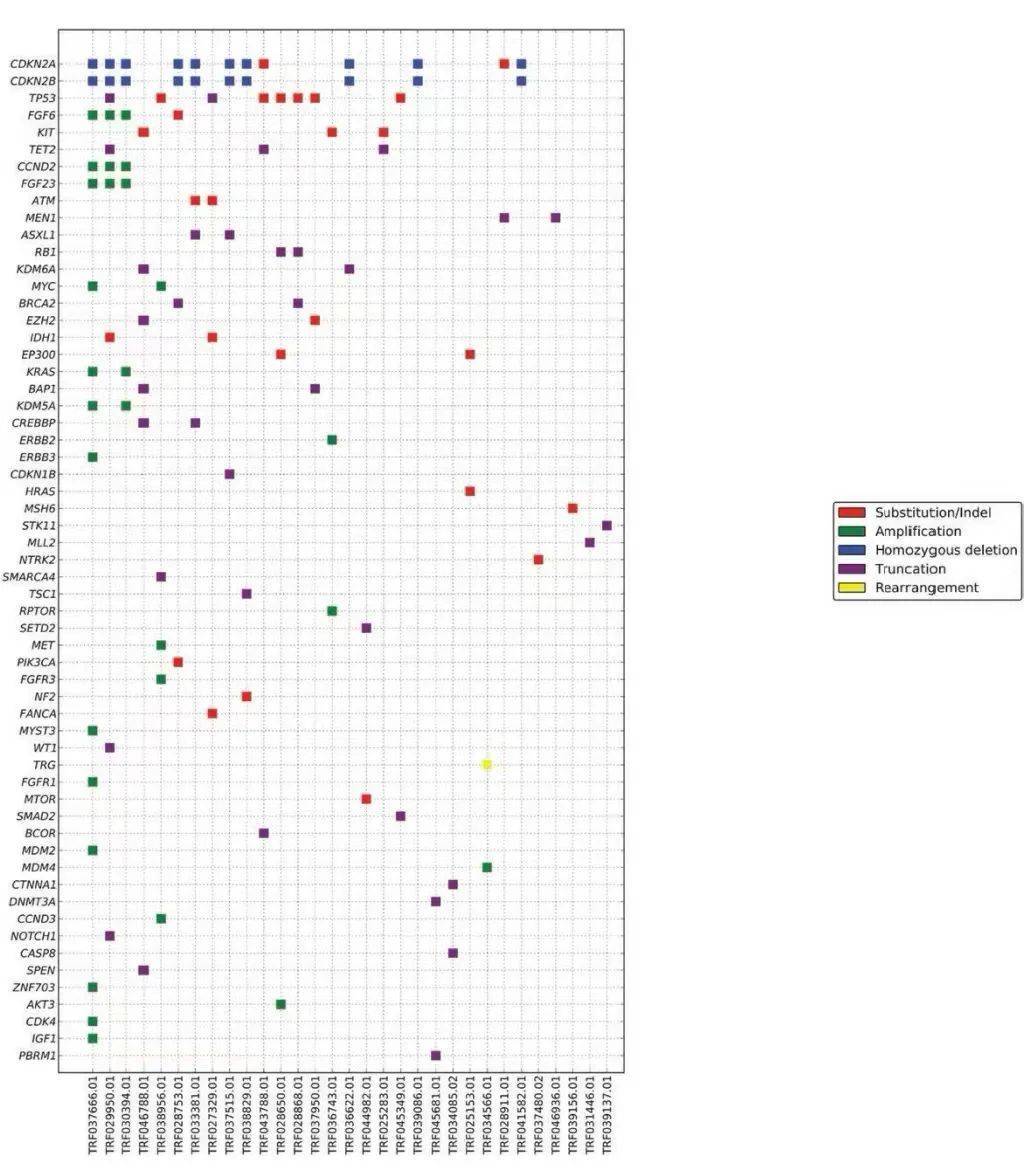
图2
在胸腺癌中,与其他亚型相比,GA在鳞状细胞癌、未分化细胞癌和神经内分泌癌中更常见(表1)。鳞状细胞癌和未分化非神经内分泌癌是本队列最常见的亚型,且在9%-10%的病例中存在特征性KIT突变(图2B和2C)。鳞状细胞癌和未分化非神经内分泌癌的GA和CRGA模式在全球范围内相似。TMB在鳞状细胞癌中最高,9%的病例表现为≥20 mut/MB。所有胸腺神经内分泌癌病例包括低级别(临床恶性类癌)和高级别肿瘤,同时具有小细胞和大细胞特征,并通过神经内分泌生物标志物免疫组化染色证实。胸腺神经内分泌癌组有近1.0个CRGA/肿瘤,具有多种潜在分子靶标,包括KIT、MET、FGFR1和TSC2(图2D),30例中只有1例存在TP53/RB1突变。
在较不常见的胸腺癌组织病理学亚型中未观察到特异性GA,这些亚型均出现不同频率的CDKN2A变异。所有这些病例都没有与EB病毒感染相关的证据。
讨论
综上所述,本研究结果表明,部分胸腺癌显示出较高的肿瘤突变负荷,这可能是免疫检查点抑制剂疗效的预测因素。据研究者所知,本队列是迄今为止报道最大的、专注于晚期胸腺上皮肿瘤全基因组图谱分析的研究。基于基因panel分析,研究者识别了难治性胸腺癌中的主要失调通路,包括细胞周期、增殖和生存、氧化应激和转录控制的失调(图2A)。先前在有限的早期切除癌队列基因组表征中发现了这些失调通路。抗凋亡与抗凋亡分子BCL2拷贝数增加有关,体内暴露于pan-BCL2抑制剂可通过PI3K/AKT/mTOR通路抑制异种移植物的生长。也有报道称,逃避生长抑制因子导致细胞周期控制分子异常,包括CDKN2A/B拷贝数丢失和启动子高甲基化,以及相关蛋白p16INK4表达缺失。此外,组蛋白修饰、DNA甲基化和染色质重塑相关基因突变也有报道。
尽管胸腺瘤中的一些GA在胸腺癌也有,包括CDKN2A/B和TP53突变,但在胸腺瘤中的发生率要低得多。在包括117例早期胸腺肿瘤切除标本的The Cancer Genome Atlas研究中,胸腺瘤的分子特征也包括A型特异性GTF2I突变,以及HRAS和NRAS突变,这些分子特征在本研究中占比相对较高。然而,这些突变罕见,破译胸腺瘤癌变的致癌机制仍然具有挑战性。
在临床中,晚期胸腺上皮性肿瘤的全基因组图谱主要旨在识别CRGA,在难治性疾病的情况下,CRGA可以预测靶向药物的疗效。KIT突变型胸腺癌在本研究中只占9%——胸腺癌的分子亚组。KIT突变作为治疗靶点仍然具有挑战性,因为根据胸腺癌和/或其他KIT突变肿瘤的临床和/或临床前证据,未经治的KIT突变患者可能对可用的KIT抑制剂敏感不一致。本研究在B3型胸腺瘤中观察到的KIT Y823D突变此前未被报道对KIT抑制剂敏感。在大多数单个病例中,KIT突变胸腺癌患者超适应症使用KIT抑制剂——伊马替尼、舒尼替尼或索拉非尼,显示反应和可能延长的生存期。使用舒尼替尼的II期临床试验也在一些长期反应者中发现了这种突变,但在这些研究中观察到的反应主要归因于通过抑制血管内皮生长因子受体而产生的血管生成效应。在胸腺上皮性肿瘤中具有临床相关性的第二个通路是PI3K通路。此前报道的突变多为PIK3R2错义突变,该突变编码PI3K的一个调控亚基。PI3K的激活也可能与A型胸腺瘤和AB型胸腺瘤19号染色体上一个大的microRNA簇的过表达有关。靶向PI3K可能是治疗胸腺恶性肿瘤的有效策略。一项使用buparlisib的II期研究目前正在进行中( ID NCT02220855)(图3)。一些关于mTOR抑制剂用于晚期胸腺上皮肿瘤的I/II期研究显示,疾病控制率很高。关于其他CRGA,本研究的一个新发现是在不可切除的III期B3型胸腺瘤中发现了潜在可靶向的NTRK1扩增。综上所述,本研究结果支持了试验或前瞻性队列的发展,通过常规使用于难治性胸腺上皮肿瘤的全基因组分析来识别CRGA,同时使用靶向药物进行治疗,CRGA在个体水平上实际上是多样化和罕见的。需要这样的研究来评估这种精准医疗的价值,这种精准医疗在其他实体癌症(如肺癌)中显示了生存获益。
图3
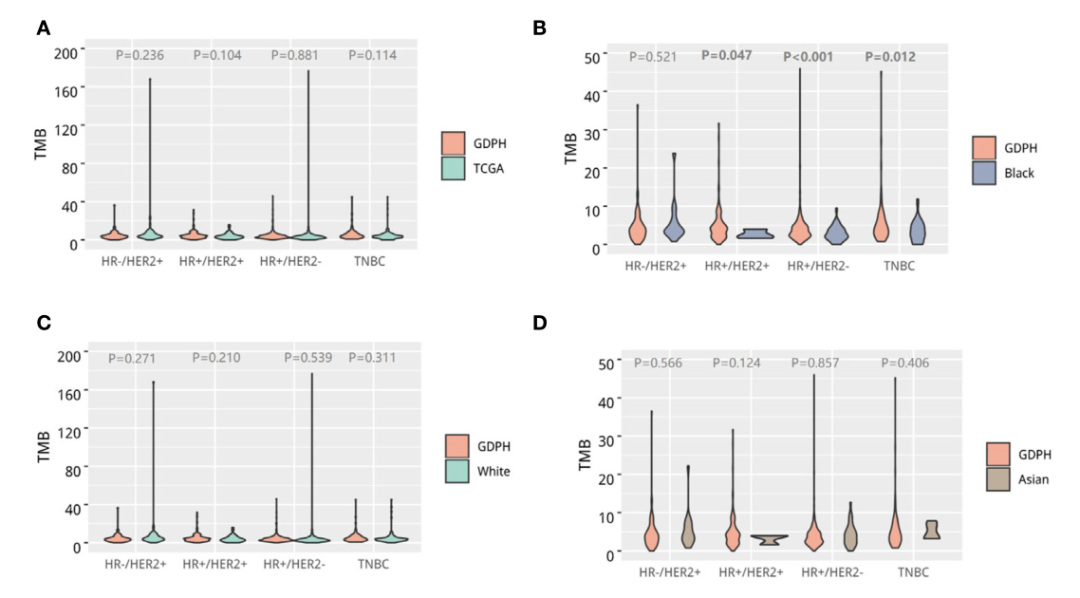
免疫检查点抑制剂在胸腺上皮性肿瘤中的应用具有挑战性。免疫治疗在胸腺瘤中实际上是禁忌的,因为三分之一的患者存在自身免疫性疾病,最常见的是重症肌无力。自身免疫紊乱通常在胸腺癌中观察不到,但据报道,暴露于靶向药物如舒尼替尼或抗PD-1抗体可发生严重的免疫相关毒性,包括肌炎、心肌炎或糖尿病。帕博利珠单抗仍可能是晚期患者的有效治疗选择。一项在41例患者中进行的II期试验报告了23%的客观缓解率,中位缓解持续时间为22个月。在这项研究中,PD-L1表达并不是反应或生存的预测因素,这可能与PD-1-PD-L1相互作用在胸腺淋巴细胞选择的调节中发挥生理作用有关。肿瘤突变负荷是免疫治疗疗效的一个预测性生物标志物,并且在临床上,对于胸腺上皮肿瘤患者可能是一个有价值的工具,有助于更好地选择抗PD-1抗体。研究结果表明,只有5%-9%的胸腺癌患者的TMB为10 mut/Mb。TMB为10 mut/Mb是先前报道的使用相同技术检测肺癌的临床相关阈值。需要进一步的研究来探讨胸腺上皮性肿瘤中的TMB。
综上所述,全基因组图谱可能对晚期难治性胸腺上皮肿瘤的治疗有很高的价值。尽管CRGA在这些肿瘤中很罕见,但CRGA可以预测创新靶向药物的疗效。同时,评估TMB有助于临床医生在讨论使用免疫检查点抑制剂治疗时做出决策,当然,在胸腺上皮肿瘤中TMB是否可作为免疫疗效的预测因素有待进一步验证。最后,虽然更深入理解胸腺上皮肿瘤的癌变机制仍然是必要的,但实施全基因组分析符合对那些罕见胸腺肿瘤个性化治疗的需要。
参考文献:
Girard N, Basse C, Schrock A, Ramkissoon S, Killian K, Ross JS. Comprehensive Genomic Profiling of 274 Thymic Epithelial Tumors Unveils Oncogenic Pathways and Predictive Biomarkers. Oncologist. 2022 Jun 24:oyac115. doi: 10.1093/oncolo/oyac115. Epub ahead of print. PMID: 35749302.







文章评论(0)