五轮疫苗(疫苗接种时间表)
新冠疫苗有五大类技术路线:1.灭活疫苗,2.腺病毒载体疫苗,3.重组蛋白疫苗,4.核酸疫苗(这里包括mRNA和DNA疫苗)5.减毒疫苗。
灭活疫苗最突出的优点是安全性好、成本低、临床进展快;腺病毒载体疫苗安全性较好,有效性需要等待三期临床结果验证,其他优势还有:成本较低,进度快;重组蛋白疫苗在安全性、有效性和成本等方面,都是比较优秀的;mRNA疫苗目前看到了初步疗效,安全性还需要进一步跟踪,生产成本相对较高,但应对新冠病毒突变的能力比较强,且不需要其他佐剂,mRNA本身就是良好的佐剂;DNA疫苗方面全球只有少数公司进入临床,其中包括Inovio。
用于对比COVID-19疫苗的主要指标包括:1. 疫苗的保护效果,2.疫苗药效的持久性,3. 疫苗的安全性。目前保护效果主要看中和性抗体的滴度,药效的持久度指标主要看T细胞免疫是否被激活,在安全性方面我们主要关注发烧情况。
在这里我们要注意的是:因为实验方法和条件的不同,中和性抗体滴度如果是相同数量级,可能无法直接比较其优劣;如果滴度差别为1-2个数量级,还是有显著临床意义的。
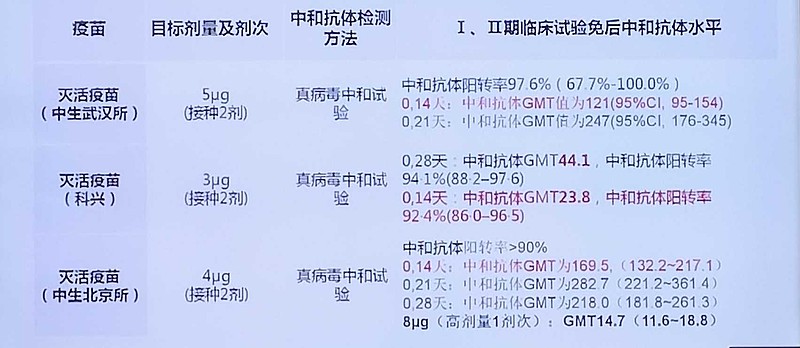
灭活疫苗:代表性企业有中国生物集团和科兴生物。使用后产生的中和抗体滴度水平在100左右,铝佐剂辅助的灭活疫苗能否激活T细胞免疫,以及保护时长还不太确定。目前数据显示此类疫苗安全性很好,进一步的数据会在8月底披露;目前科兴已经在巴西,孟加拉国;中生集团(武汉所、北京所)在阿联酋,分别进入临床三期。若进展顺,有望在2020年年底之前获批。
腺病毒载体疫苗:代表企业有康希诺生物和阿斯利康。主要针对全长S蛋白,能产生8种类型左右的中和性抗体,康希诺的二期临床数据显示腺病毒载体疫苗能够刺激T细胞免疫,这一点非常突出。阿斯利康的腺病毒载体疫苗也获得了T细胞免疫,同时也可以获得相对较高的抗体滴度,大约在200左右。 阿斯利康的腺病毒载体疫苗是全球最快进入三期临床的,预计最快9月份可能看到部分三期数据,获得紧急授权使用。康希诺生物腺病毒载体疫苗能激活T细胞免疫,p值很小为0.001,说明非常显著,预示此类疫苗如果有效,保护效果可能持续相对比较久的时间 ;安全性方面,高剂量组出现8%三级(G3)发 热(38.5-39.5°C),在可以接受范围内。科兴生物测试康复患者早期中和抗体滴度在20-60左右,小鼠模型中和抗体滴度是1500,大鼠是2000,猴子是60;而在猴子攻毒实验中,中和抗体滴度迅速爬到200-400。
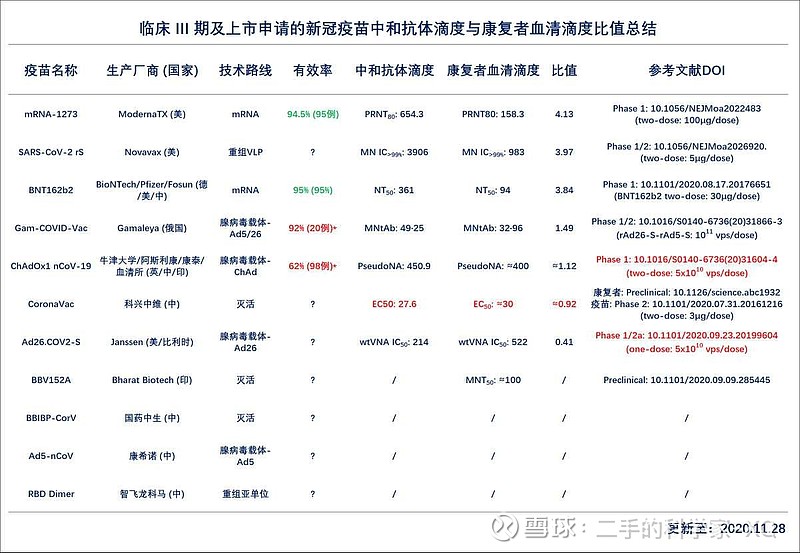
重组蛋白疫苗:代表企业主要有三叶草、智飞生物和Novavax。Novavax疫苗的中和抗体滴度水平在3000-4000左右,这个数据是目前为止在人体临床实验里中和性抗体滴度最高的。目前在二期临床,有望在2021年上半年获批。国内的重组蛋白疫苗采用了不同的抗原设计,总体上中和抗体的滴度都很高,智飞生物的疫苗已进入二期临床,三叶草的重组蛋白疫苗在一期临床,预计将在2021-2022年获批大规模使用。智飞生物的重组蛋白疫苗在猴子实验 上,中和性抗体可以达到2000。三叶草利用“蛋白质三聚体化”专利技术平台,成功研制了“S蛋白-三聚体”疫苗,保持了新冠病毒S蛋白天然三聚体的结果和抗原性,正在澳大利亚开展一期临床实验。这个很有可能是匹黑马,我们拭目以待。
DNA疫苗方面:目前Inovio联合国内公司-艾棣维欣,开发的DNA疫苗已经进入一期临床,临床前小鼠模型中和抗体滴度为100。Novavax重组蛋白疫苗,在小鼠模型中和抗体滴度一万,在狒狒模型第35天中和抗体滴度达到一 万,在食蟹猴中也同样达到一 万。本周报道Novavax重组蛋白疫苗临床一期数据中,5微克的剂量,中和性抗体达到3906(4.0倍于康复病人体内中和性抗体滴度),25微克剂量中和性抗体可以达到3305 (3.4倍于康 复病人体内中和性抗体滴度),虽然由于所用测试方法的差异,Novavax/Baylor测得的康复病人体内的中和性抗体滴度6-10倍于Moderna和BioNtech报道的康复病人体内中和性抗体的滴度;但对比于其他疫苗,重组蛋白疫苗的中和性抗体的滴度仍然公认是最高的。
除了抗体滴度高,Novavax一期临床数据还证实了,含有皂苷的佐剂非常明显的激活了Th1细胞免疫,预示疫苗保护时长会比较长;同时避免了Th2细胞免疫的激活,根据公司的假设,预期ADE风险比较小。Inovio使用的是全长S蛋白的DNA疫苗,Inovio鉴定出了9个T细胞表位,其中只有6个在RBD区域,有3个不在,理论上预示着S蛋白抗原激活的T细胞免疫可能更为全面。
目前Inovio/艾棣维欣的DNA疫苗,小鼠实验中和性抗体滴度为100。mRNA疫苗:国内外多家企业在进行开发,技术路线简而言之:是将表达新冠病毒S蛋白或者RBD部分的mRNA序列 ,利用脂质体纳米颗粒包裹后,递送到细胞内,在体内表达出新冠病毒相关蛋白,发挥出预防性疫苗的作用。全球进度最快的是Moderna,在2020年5月底进入2期临床,然后在7月底进入3期临床,是全球第一个进入3期临床的新冠mRNA疫苗,预计今年年底批准上市。后续进度较快的包括BioNTech,目前在2期临床;CureVac目前在1期临床;Translate Bio/Sanofi 在临床前阶段。国内进度最快的是苏州艾博生物(Abogen),在2020年6月底进入1期临床,合作方为军科院和沃森生物。目前国内其他企业包括珠海丽凡达,上海斯微,杭州西海等尚在临床前阶段。Moderna和BioNTech的mRNA新冠疫苗都披露了比较完整的一期临床数据,Moderna采用S蛋白全长,候选品种一期临床数据展现了出色的中和性抗体诱导能力,中高剂量组在免疫后43天,产生的中和性抗体滴度分别达到了康复病人血清的中和抗体滴度的2.2倍和4.1倍。BioNTech在一期临床数据中也显示出了中和性抗体诱导能力,中高剂量组在免疫后分别达到了康复病人血清的中和抗体滴度的1.8和2.8倍。





文章评论(0)