等效平衡(等效平衡的三种类型)
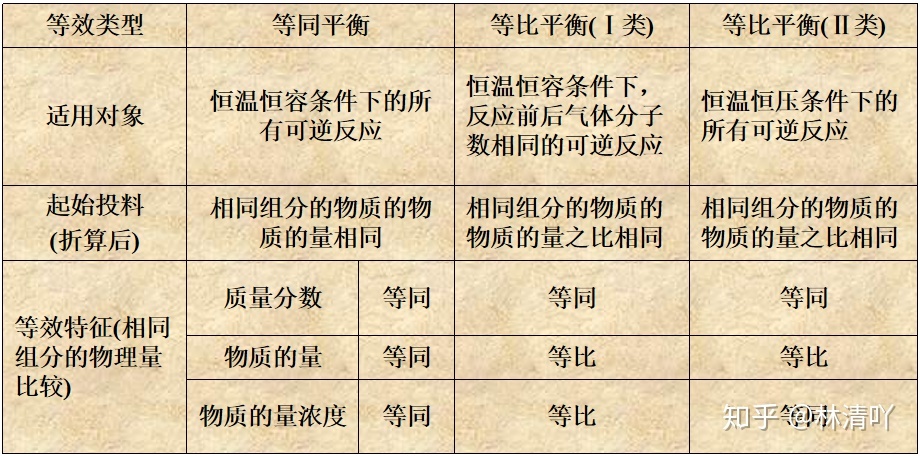
第二章第三节 化学平衡等效平衡我们知道:对于一个可逆反应,既可以从正反应开始达到平衡,也可以从逆反应开始达到平衡,当反应条件(温度,体积,压强)一定,起始的加入量相同时,最后的平衡状态是一样的(一样指的是:质量分数、体积分数等),如看下图:起始C(mol/L) 2 10平衡C(mol/L) 0.8 0.4 1.2 例: 2SO2+ O2 2SO3 2SO2+ O2 2SO3 0 02 0.8 0.4 1.2以上两个平衡,有什么异同?为等效平衡等效平衡的定义:(等量等效和等比等效) 在一定条件下(恒温恒容或恒温恒压),对同一可逆反应,只是起始时加入物质的物质的量不同,而达到化学平衡时,同种物质的百分含量相同或体积分数相同,这样的平衡称为等效平衡。(但物质的量浓度不一定相等)如何判断是否是等量等效平衡:归边法:恒T、V条件下,把物质全部转化到左边或右边后,若相同物质起始物质的量相等,则为等量等效平衡效果:两平衡为一模一样的平衡。平衡时,两组平衡什么(浓度、体积分数等)都一样。 已知:2SO2+ O2 2SO3 SO2 O2 SO3 1、 2mol 1mol 1mol 归边后: 2、 0 0 2 归边后: 3、 1 0.5 2 归边后: 4、 0 2 2 归边后: 归边法:把物质全部转化到左边或右边31.5021031.50230恒T、V1与3建立的是等量等效平衡有一个固定体积的密闭容器中,加入2molA和1molB发生反应,2A(g) + B(g) 3C(g) + D(g)达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达平衡时C的浓度仍为Wmol/L的是( )A.4mol A + 2mol BB.2mol A + 1mol B + 3mol C + 1mol DC.3mol C + 1mol D +1mol B D.3







文章评论(0)