脂肪瘤鉴别诊断(鉴别诊断脂肪瘤图片)
DOI: 10.3760/112-00041
摘要
乳腺单纯梭形细胞病变少见,但发生于乳腺的部分肿瘤或瘤样病变可以主要由梭形细胞构成。在取材不够充分、活检或粗针穿刺的标本中,甚至全部由梭形细胞构成。它们往往不同于其他部位软组织的梭形细胞肿瘤,而有其独特规律。乳腺梭形细胞病变通常是乳腺特有的病变,如梭形细胞化生性癌、叶状肿瘤、细胞性纤维腺瘤等,而不是纯粹的肉瘤。如果缺乏对乳腺梭形细胞病变特征的认识,缺乏正确的诊断思路,容易导致误诊。本文主要讨论以梭形细胞增生为主乳腺病变的病理诊断思路、鉴别诊断及相关研究进展。
正 文
组织学上,乳腺梭形细胞病变的细胞形态可以具有不同程度的异型性,也可以温和无异型。但看似温和的梭形细胞病变并非一定是良性病变,部分梭形细胞病变的形态特征并不能反映病变的真实性质,如对其认识不足,也难以正确诊断。如果乳腺梭形细胞病变具有细胞丰富、异型性明显、核分裂象多等恶性或肉瘤样形态学特征,首先要考虑的是发生于乳腺的梭形细胞化生性癌或者恶性叶状肿瘤,然后再考虑其他原发于乳腺的梭形细胞肉瘤或结节性筋膜炎等假肉瘤样病变,最后再考虑具有梭形细胞特点的转移性肿瘤,如恶性黑色素瘤等。因为原发于乳腺的肉瘤及转移性梭形细胞病变都相当罕见。也就是说,具有肉瘤样形态的乳腺肿瘤更可能是梭形细胞化生性癌或者恶性叶状肿瘤,而不是原发性肉瘤。如果乳腺肿瘤梭形细胞形态较温和,首先要考虑纤维瘤病样化生性癌。如果是活检或粗针穿刺的标本,还要考虑到纤维腺瘤和良性叶状肿瘤的可能。之后,再考虑发生于乳腺的其他良性梭形细胞病变,如肌纤维母细胞瘤、炎性肌纤维母细胞瘤、韧带样型纤维瘤病、平滑肌瘤、神经鞘瘤、孤立性纤维性肿瘤等。因为原发于乳腺的良性间叶源性肿瘤更少见。我们根据梭形细胞异型性大小等形态特征,讨论几种相对常见的乳腺梭形细胞病变。
一、具有肉瘤样形态特征的乳腺梭形细胞病变
原发于乳腺的具有肉瘤样形态的梭形细胞肿瘤主要包括化生性梭形细胞癌和恶性叶状肿瘤。间叶源性恶性肿瘤、结节性筋膜炎等也可发生于乳腺,但相当少见。
1.梭形细胞癌
当乳腺浸润性癌伴梭形细胞分化,主要或全部由中-重度不典型梭形细胞构成时,称为梭形细胞癌,属于化生性癌的一种亚型。梭形细胞癌的组织学特征是肿瘤性梭形细胞呈鱼骨样、车辐样等不同方式排列。梭形细胞中-重度不典型,核分裂象易见(图1,2)。有时可见局灶上皮样形态或鳞状分化,以及导管原位癌的存在,局灶上皮样形态是梭形细胞癌的重要诊断线索。免疫组织化学:广谱细胞角蛋白(CKpan)和高相对分子质量角蛋白如细胞角蛋白(CK)14、CK5/6、34βE12不同程度阳性。文献报道约80%化生性癌CKpan阳性,约70%的CK5/6、CK14、34βE12阳性,CK7等低相对分子质量角蛋白通常阴性[1]。2012年WHO乳腺肿瘤病理学分类标准将乳腺恶性肌上皮瘤/肌上皮癌归为梭形细胞化生性癌,梭形细胞癌常不同程度表达肌上皮分化标志物p63,表皮生长因子受体(EGFR)也通常阳性。而CD34通常阴性,有别于叶状肿瘤。梭形细胞癌ER、PR、HER2均阴性,为三阴性基底细胞样型乳腺癌。因为提示上皮分化的角蛋白可仅为灶性表达,上皮样细胞也可能是灶性甚至见不到,因此充分取材非常重要。我们遇到的4例梭形细胞癌中,3例都出现多少不等的上皮样形态,免疫组织化学显示均为三阴性基底细胞样型乳腺癌。CKpan、p63均有不同程度的阳性(图3,图4,图5),高Ki-67阳性指数(图6)。其中1例做了2个蜡块后,才显示出局灶p63阳性区域。因此,当1个蜡块的免疫组织化学结果还不能解决问题时,换个蜡块再做,也许会有帮助。

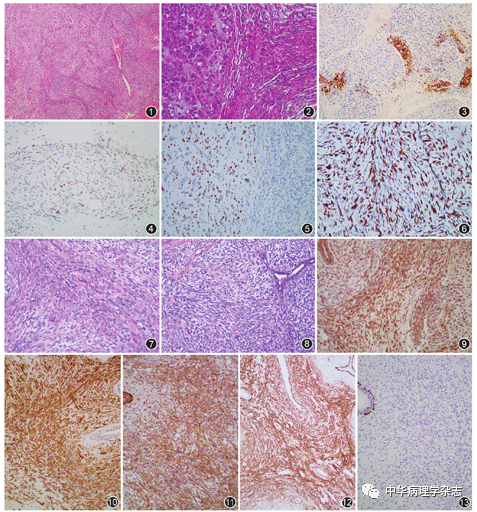
图1~6 梭形细胞癌图1肿瘤性梭形细胞束状排列,细胞中-重度不典型,可见局灶上皮样细胞形态 HE 低倍放大;图2肿瘤主要由致密梭形细胞构成,局灶见上皮细胞巢 HE 中倍放大;图3上皮样细胞广谱细胞角蛋白阳性 EnVision法 低倍放大;图4梭形细胞p63局灶阳性 EnVision法 中倍放大;图5上皮细胞巢p63阳性 EnVision法 低倍放大;图6致密梭形细胞Ki-67高表达 EnVision法 中倍放大
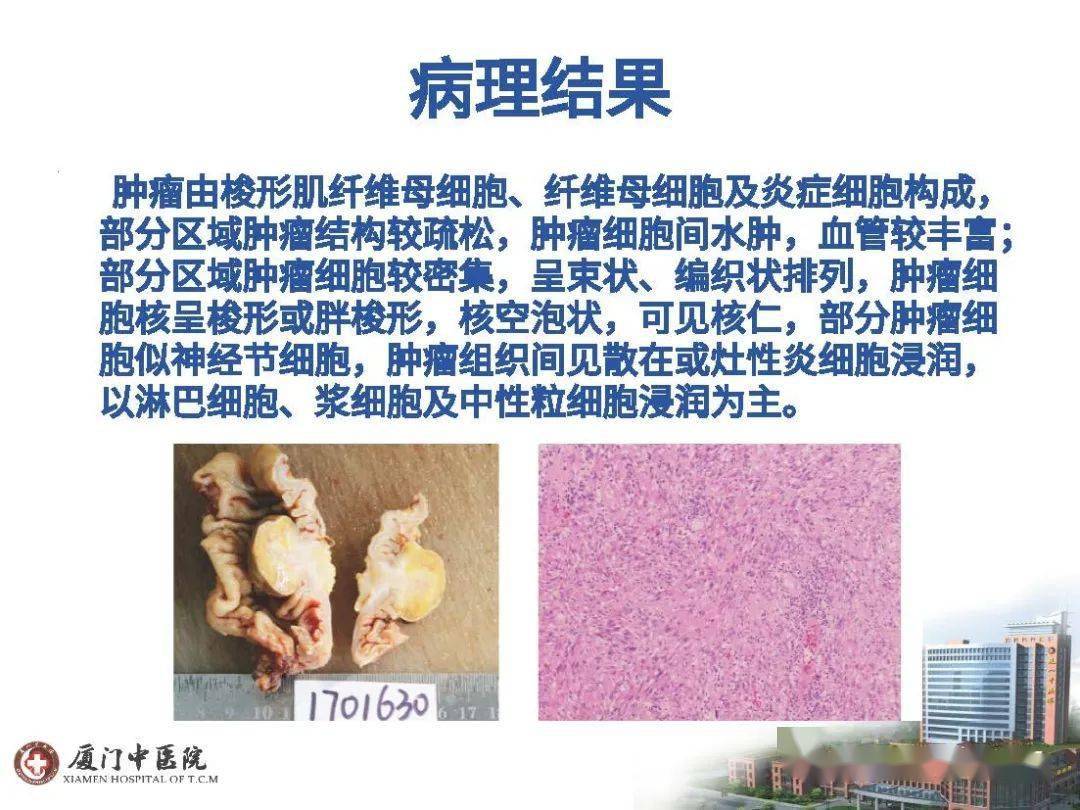
图7~13 恶性叶状肿瘤图7恶性叶状肿瘤由异型明显梭形细胞构成HE中倍放大;图8局灶见双层上皮成分 HE 中倍放大;图9~13 EnVision法中倍放大图9示bcl-2阳性;图10示CD34阳性;图11示β-catenin阳性;图12示CD10阳性;图13示p63阴性
当肿瘤完全没有上皮样形态时,梭形细胞癌的鉴别诊断主要是恶性叶状肿瘤。梭形细胞癌不会出现叶片状结构,但恶性叶状肿瘤间质过度增生时,有时也难见叶片状结构,在活检小标本时更是如此。鉴别化生性梭形细胞癌与恶性叶状肿瘤的最有用标志物包括:高相对分子质量CK、p63、CD34和bcl-2。CK和p63在梭形细胞癌阳性,至少灶性阳性,而在叶状肿瘤常阴性;相反,CD34和bcl-2在化生性乳腺癌阴性,在叶状肿瘤通常阳性[1]。其次,梭形细胞癌要与原发于乳腺的梭形细胞肉瘤鉴别,原发性肉瘤缺乏上皮成分,免疫组织化学染色存在特异性分子标志物。此外,还要与假肉瘤样结节性筋膜炎和其他转移性梭形细胞肿瘤鉴别。
当遇到具有肉瘤样形态的乳腺梭形细胞病变时,诊断思路是:只有完全排除了梭形细胞癌的诊断,才能考虑其他梭形细胞病变。而诊断梭形细胞癌的关键是:必须通过组织形态学和/或通过免疫组织化学染色证实有上皮分化的存在。实际工作中,免疫组织化学染色p63和/或上皮标志物CK阳性常常是诊断梭形细胞癌的最有力证据。在单纯的梭形细胞病变中,只要出现高相对分子质量角蛋白阳性区域,都应该诊断梭形细胞癌。
梭形细胞癌占所有浸润性乳腺癌不到1%。梭形细胞癌的临床特点与非特殊型浸润性乳腺癌相似。肿块通常较非特殊型浸润性乳腺癌略大。梭形细胞癌对常规辅助化疗反应较差,临床预后一般较差。
尽管化生性癌多为三阴性乳腺癌,但其临床病理特征不同于其他三阴性乳腺癌。不仅组织形态不同,其基因表型也不一样,而且不同组织学亚型化生性癌的基因表型具有异质性。化生性癌更易出现PIK3CA/PIK3R1通路的异常和TP53基因突变,但化生性梭形细胞癌则缺乏TP53基因突变[2],表明其不同于其他化生性癌的基因改变。研究显示[3],位于9p21.3上的CDKN2A(p16)缺失和PIK3CA突变可能是梭形细胞癌特征性基因改变。分子研究表明,梭形细胞癌存在上皮间质转化的转录特征,属于claudin-low分子亚型乳腺癌。
2.恶性叶状肿瘤
乳腺叶状肿瘤是一组纤维上皮性肿瘤,分为良性、交界性和恶性。恶性叶状肿瘤多见于中年妇女。我们收集的5例恶性叶状肿瘤,年龄17~52岁,平均年龄41岁。叶状肿瘤可以很大,但平均大小仍在4~5 cm左右。大体上,肿块边界多较清楚,特征性叶芽样弯曲裂隙状结构在大的病变中多见。组织学上,当肿瘤间质梭形细胞弥漫性增多,过度生长,以致一个低倍视野见不到上皮,而且梭形细胞核明显异型,核分裂象增多(≥10/10 HPF),以及具有浸润性边界等恶性特征时,诊断为恶性叶状肿瘤。
典型恶性叶状肿瘤镜下可见由良性上皮成分和恶性间质成分构成的叶片状结构,容易诊断。由于恶性叶状肿瘤多以间质细胞显著增生为主,有些病例可能难以见到叶片状结构,甚至见不到双层上皮成分。组织形态上与梭形细胞癌、肉瘤相似,难以区分(图7,图8)。
恶性叶状肿瘤的鉴别诊断主要是化生性梭形细胞癌。与化生性癌一样,恶性叶状肿瘤中的梭形细胞具有多形性、丰富的核分裂象,而且都可出现恶性异源性成分。这时,充分取材发现肿瘤中由腺上皮和肌上皮构成的双层上皮成分或叶片状结构是诊断恶性叶状肿瘤的关键之一。其次,CK、p63阴性,不表达特异性肉瘤标志物,对叶状肿瘤的诊断也具有重要作用。β-catenin核阳性是纤维瘤病和叶状肿瘤的共同特征[4],但在化生性癌中少见表达。约75%叶状肿瘤CD34阳性,但CD34随着叶状肿瘤级别增高表达减弱[5]。CD10、p53、CD117、EGFR在叶状肿瘤中都不同程度阳性,而且随着叶状肿瘤级别增高而表达增强。虽然p63、p40、CK阳性是诊断梭形细胞癌的重要依据,也有研究观察到p63、p40、CK在部分恶性叶状肿瘤中灶状阳性[6]。因此,单一的标志物不能很好帮助鉴别诊断,只有使用一组免疫组织化学指标,结合形态学才能提高诊断准确率。我们遇到的5例恶性叶状肿瘤,bcl-2、CD34、β-catenin、CD10都呈不同程度阳性(图9,图10,图11,图12),CKpan、p63均阴性(图13)。我们认为,bcl-2、CD34、β-catenin、CD10阳性有助于恶性叶状肿瘤诊断;而CK、p63、p40阳性有助于梭形细胞癌诊断。恶性叶状肿瘤与梭形细胞癌的治疗方案有所不同,鉴别诊断具有临床意义。恶性叶状肿瘤一般选择肿块完整切除,而不推荐常规前哨淋巴结清扫。手术后放化疗的作用尚不确定。但梭形细胞癌的治疗常需要新辅助化疗或化疗,外科手术包括前哨淋巴结切除[7]。
恶性叶状肿瘤可以出现异源性的脂肪肉瘤、骨肉瘤、软骨肉瘤等分化,有时骨肉瘤等异源分化可为肿瘤的主要成分,即使如此,还是应该诊断恶性叶状肿瘤,而不是骨肉瘤等单纯性肉瘤。
分子研究显示,恶性叶状肿瘤存在MED12外显子2突变,而乳腺梭形细胞癌及单纯性肉瘤几乎没有该基因的突变。Lien等[8]报道,与乳腺梭形细胞癌及原发性肉瘤等相比,MED12外显子2突变对叶状肿瘤诊断特异度100%,灵敏度73.6%。新近研究表明,乳腺纤维腺瘤以及良性、交界性和恶性叶状肿瘤都常发生MED12外显子2体突变[9]。所以在纤维上皮性肿瘤中,MED12外显子2体突变不具特异性。与梭形细胞癌一样,恶性叶状肿瘤也存在上皮间质转化,属于claudin-low三阴性基底样乳腺肿瘤。Cani等[10]报道恶性叶状肿瘤存在p53、RB1、NF1基因突变以及EGFR和IGF1R基因扩增,而且希望EGFR和IGF1R可能成为化疗靶点。
3.结节性筋膜炎
是一种纤维母细胞/肌纤维母细胞克隆性增生形成的成瘤性、自限性疾病。由于其肥胖纤维母细胞/肌纤维母细胞可具有明显异型性,核分裂象也可以很多,因此又称为假肉瘤性筋膜炎,有时易误诊为肉瘤,发生于乳腺时需与梭形细胞癌、恶性叶状肿瘤鉴别[11]。当结节性筋膜炎的梭形细胞异型性不明显时,则要与良性或低度恶性的梭形细胞病变鉴别。
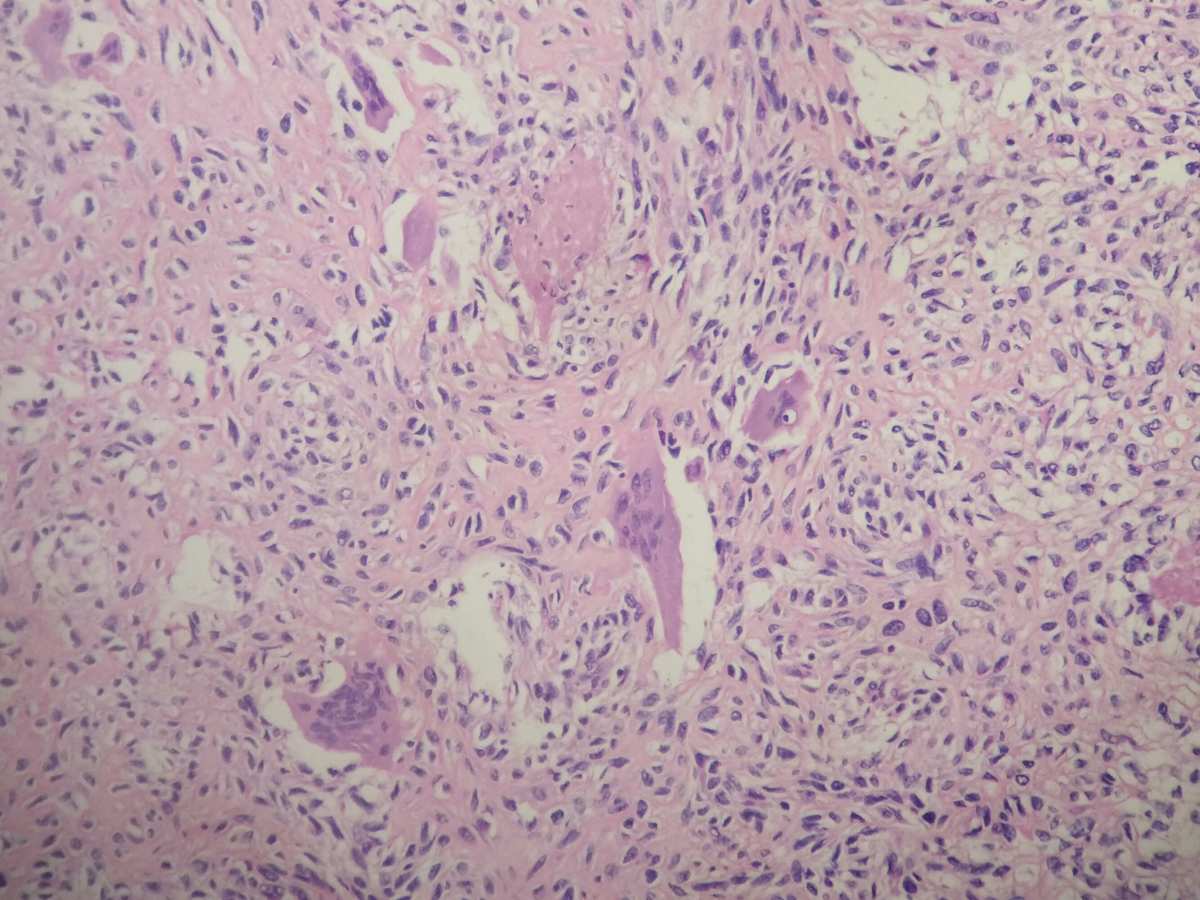
结节性筋膜炎多发生于皮下浅筋膜,发生于乳腺实质者少见。该病变属于良性肿瘤性病变,存在MYH9-USP6基因融合。发生于乳腺实质的结节性筋膜炎,其病理形态特征与发生于其他部位皮下组织的结节性筋膜炎一样。为界限相对清楚但无包膜的结节。镜下由短束状排列的梭形细胞构成,胞质淡染、嗜酸性,胞核肥胖、空泡状,可有不同程度异型性,有时异型很明显。核分裂象常多见,但无病理性核分裂象。间质疏松、黏液样或瘢痕样玻璃样变性。病变境界通常清楚,虽然部分病例有时出现局灶性浸润边缘,但无坏死。薄壁血管和红细胞渗漏也是其特点之一(图14)。免疫组织化学染色α-平滑肌肌动蛋白(SMA)总是阳性(图15),CK、结蛋白、S-100蛋白和CD34通常阴性。分子生物学能检测到MYH9-USP6基因融合是其重要分子遗传学特征,也是诊断该病变的重要依据。典型的临床表现,如肿块生长迅速、伴有疼痛等有助于结节性筋膜炎的诊断。结节性筋膜炎可在1~2个月后自发消退,局部复发非常少见。
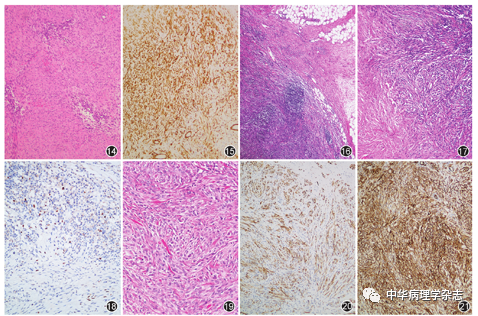
图14,15 结节性筋膜炎图14结节性筋膜炎由短束状排列的肥胖梭形细胞构成,可见红细胞渗漏 HE 中倍放大;图15胞质α-平滑肌肌动蛋白阳性 EnVision法 中倍放大
图16~18 纤维瘤病样化生性癌图16示梭形细胞浸润至脂肪组织,肿瘤边界不清HE中倍放大;图17示温和梭形细胞呈交错束状排列,不同程度胶原化HE中倍放大;图18示少许梭形细胞p63阳性 EnVision法 中倍放大
图19~21 肌纤维母细胞瘤图19示杂乱交叉排列的梭形细胞间,见强嗜酸性绳索样胶原 HE 高倍放大;图20示肿瘤细胞结蛋白阳性 EnVision法 中倍放大;图21示肿瘤细胞CD34阳性 EnVision法 中倍放大
4.乳腺原发性肉瘤

相当少见,其中血管肉瘤是乳腺肉瘤中最常见的肿瘤,可以原发于乳腺实质,也可继发于乳腺癌手术及术后放疗后的乳腺组织或皮肤肿瘤累及乳腺。分化差的血管肉瘤异型性明显,有时主要由梭形细胞构成,如取材不充分,可能很难见到肿瘤性血管腔结构,需与梭形细胞癌、恶性叶状肿瘤鉴别。CD31、CD34、D2-40等内皮标志物阳性有助于血管肉瘤诊断。高分化血管肉瘤细胞异型性小,需要与血管瘤样间质增生、血管脂肪瘤、良性血管病变等鉴别。高分化血管肉瘤的血管腔有不同程度地扩张或成角,并相互吻合,可区别于良性病变。
此外,乳腺还可发生骨肉瘤、脂肪肉瘤、横纹肌肉瘤、平滑肌肉瘤等。发生于乳腺的肉瘤与发生于其他部位发生的肉瘤具有相似的临床病理特征。特别要注意的是,当乳腺肿瘤中出现骨肉瘤等肉瘤样成分时,必须排除乳腺化生性癌和恶性叶状肿瘤后,方能诊断,即使含有极少许化生性癌或恶性叶状肿瘤成分,也不能诊断原发性肉瘤。
二、具有温和形态特征的乳腺梭形细胞病变
原发于乳腺的具有温和形态的梭形细胞病变虽然不多见,但病变类型多样。具有温和形态的梭形细胞肿瘤发生于其他部位通常良性居多,但发生于乳腺的经常并非良性。低级别纤维瘤病样化生性癌是首先要考虑到的病变,纤维瘤病样化生性癌形态温和,很容易被忽视。如果是穿刺活检组织,还要排除纤维腺瘤和良性、交界性叶状肿瘤,最后再考虑其他原发于乳腺的良性间叶源性肿瘤等梭形细胞病变。
乳腺原发的具有温和形态特征梭形细胞病变还包括:结节性筋膜炎、活检后反应性梭形细胞结节、假血管瘤样间质增生、肌纤维母细胞瘤、炎性肌纤维母细胞瘤、韧带样型纤维瘤病、神经鞘瘤、平滑肌瘤、梭形细胞脂肪瘤、孤立性纤维性肿瘤、黏液瘤等[12]。其中乳腺结节性筋膜炎、反应性梭形细胞结节、炎性肌纤维母细胞瘤及肌纤维母细胞瘤都是纤维母细胞/肌纤维母细胞增生性病变;前3种病变具有相似的在形态学及免疫组织化学染色特征,都不同程度表达α-SMA和calponin,造成鉴别诊断困难。这时临床信息对鉴别诊断有较大的帮助,如乳腺穿刺病史有助于反应性梭形细胞结节的诊断;而伴有疼痛、生长迅速的结节有助于结节性筋膜炎的诊断。镜下,丰富的黏液样间质、较多的生理性核分裂象及肉芽样组织结构支持结节性筋膜炎的诊断;而较多的浆细胞浸润及梭形细胞间变性淋巴瘤激酶阳性则支持炎性肌纤维母细胞瘤的诊断。肌纤维母细胞瘤的组织形态变化较多,但其免疫组织化学染色颇具特征。
下面就几种乳腺相对较多见的具有温和形态特征的乳腺梭形细胞病变加以介绍。
1.纤维瘤病样化生性癌
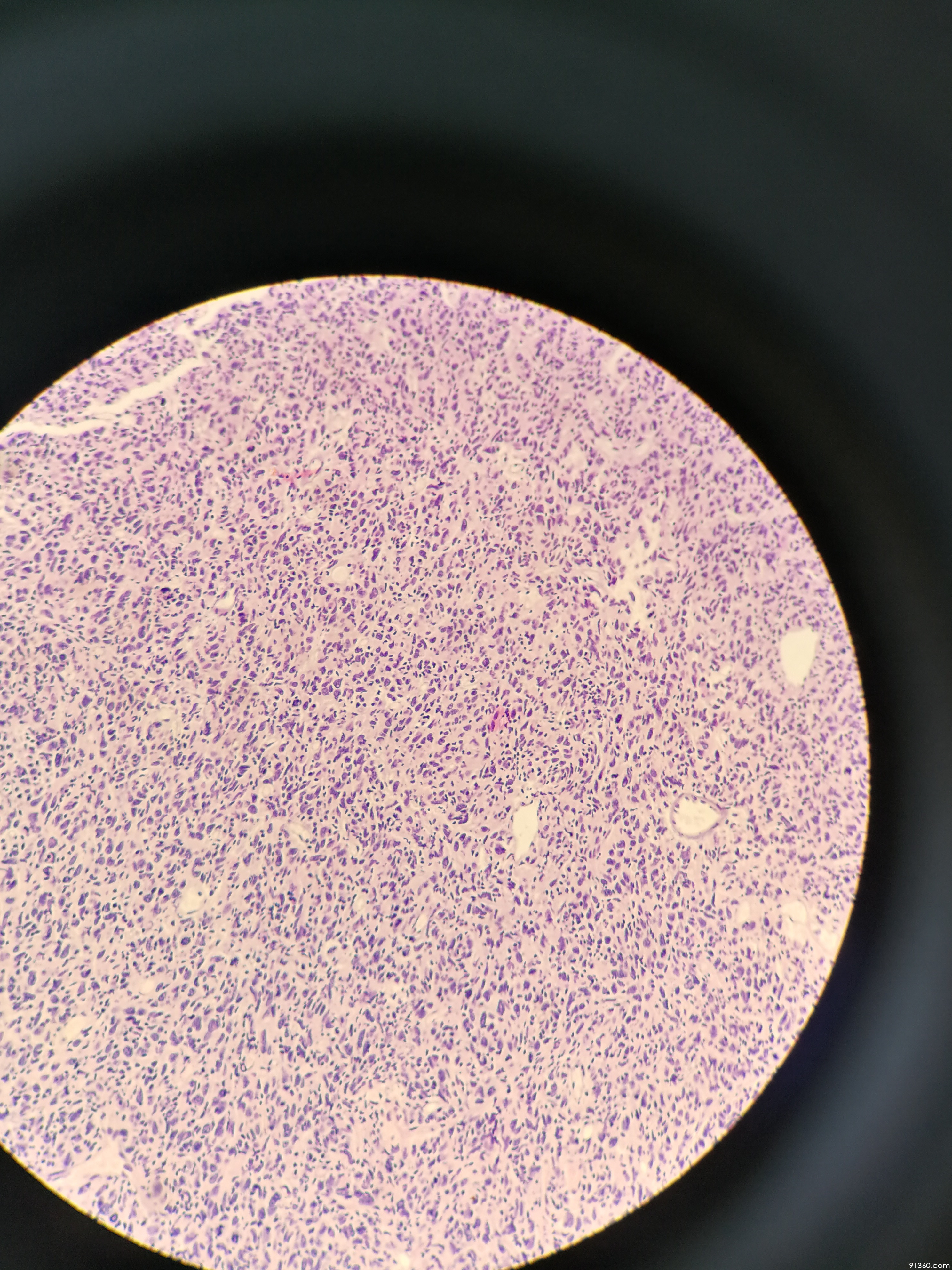
既往被归入化生性梭形细胞癌,因其温和的梭形细胞形态特征及较好的临床预后,2012年WHO乳腺肿瘤病理学分类标准将其分为化生性癌中一个独立的病理亚型。其肿瘤性梭形细胞常呈指突状浸润至周围乳腺实质中,类似于韧带样纤维瘤病的浸润性生长方式。
镜下,纤维瘤病样化生性癌由短梭形或长梭形细胞构成。梭形细胞形态温和,胞质淡嗜酸性,细胞核无异型或轻度异型,核分裂象罕见。梭形细胞常呈波浪状、交错束状排列,指突状浸润至周围乳腺实质中,致肿瘤边界不清,间质不同程度胶原化(图16,图17)。不同于其他梭形细胞病变,纤维瘤病样化生性癌总会存在某些上皮分化的特征,或出现灶性上皮样细胞。p63通常阳性(图18),CK阳性,但有时仅为灶性阳性。
该病变具有浸润性边界,不易误诊为具有清楚境界的良性梭形细胞病变,主要鉴别诊断是韧带样纤维瘤病及浸润亚型肌纤维母细胞瘤。当具有浸润性边界时,只要出现p63、CK阳性区域或局灶上皮分化特征,都应该诊断纤维瘤病样化生性癌。而缺乏任何上皮分化的痕迹,p63、CK阴性,β-catenin梭形细胞核阳性,则诊断韧带样纤维瘤病。浸润亚型肌纤维母细胞瘤也具有浸润性边界,但其特征性CD34及结蛋白双阳性有助于诊断。
2.结节性假血管瘤样间质增生
假血管瘤样间质增生是一种由乳腺间质肌纤维母细胞增生形成的良性病变。常存在于各种良性和恶性乳腺病变的局灶区域,显微镜下被偶尔发现。因其镜下特征为具有互相吻合、裂隙样假血管腔而得名。少数情况下,假血管瘤样间质增生亦可形成可触及的或影像学可发现的肿块,称为结节性或成瘤性假血管瘤样间质增生。结节性假血管瘤样间质增生通常为无包膜、界限清楚的分叶状结节。
镜下,由不规则、相互吻合的裂隙状假血管腔组成,需与高分化血管肉瘤进行鉴别。高分化血管肉瘤CD34、CD31等内皮标志物阳性,而结节性假血管瘤样间质增生除了可以表达CD34外,CD31等其他内皮标志物均阴性有助鉴别。有时,结节性假血管瘤样间质增生的裂隙样假血管腔并不明显,甚至毫无痕迹,增生的梭形细胞呈束状排列,被瘢痕样胶原分割,这时需与其他梭形细胞病变鉴别。该病变通常没有黏液样间质及炎性细胞浸润,CD34通常阳性。可不同程度表达SMA、结蛋白、calponin及PR。假血管瘤样间质增生常发生于更年期性激素紊乱的女性,这种增生的乳腺间质肌纤维母细胞是对性激素的异常反应[13]。
3.肌纤维母细胞瘤
是由纤维母细胞和肌纤维母细胞形成的乳腺间质良性肿瘤。通常为界限清楚、无包膜的肿块。经典的肌纤维母细胞瘤由形态温和的梭形细胞构成,细胞排列成杂乱交叉的短束状,被强嗜酸性的绳索样胶原带分割(图19)。结合其肿瘤细胞结蛋白和CD34弥漫阳性的免疫组织化学染色特征(图20,图21),病理诊断一般不会存在问题。除了结蛋白、CD34恒定阳性外,肌纤维母细胞瘤可不同程度表达ER、PR、bcl-2、CD99和CD10[14]。肌纤维母细胞瘤还有一些组织形态变型,形态变化多样,需要与几乎所有乳腺梭形细胞病变鉴别。肌纤维母细胞瘤可以出现脂肪组织、上皮样或蜕膜样细胞。当出现上皮样或蜕膜样细胞,尤其当上皮样细胞核具有轻度异型时,需要与浸润性小叶癌、纤维瘤病样化生性癌等鉴别。上皮样细胞可单行排列于胶原中,还可以表达ER、PR,因此,在穿刺小标本中,很可能误诊为浸润性小叶癌。这时,一组包括上皮、肌纤维母细胞的标志物及结蛋白、CD34对鉴别诊断有很大帮助。目前认为,梭形细胞脂肪瘤或脂肪瘤样肌纤维母细胞瘤属于肌纤维母细胞瘤的一种变型,二者有相同的13q区染色体重排,导致相关的Rb基因或FOXO1基因缺失[15]。浸润亚型肌纤维母细胞瘤具有浸润性边界,需要与韧带样纤维瘤病、纤维瘤病样化生性癌鉴别。韧带样纤维瘤病的梭形细胞核通常表达β-catenin,纤维瘤病样化生性癌表达CK、p63,而且都不表达结蛋白、CD34,可资鉴别。
总之,在诊断以梭形细胞增生为主的乳腺病变时,要牢记两点。第一,不能仅根据细胞形态异型性的程度来判断病变的良恶性;第二,只有排除了乳腺特有的梭形细胞病变,如梭形细胞癌、纤维瘤病样化生性癌、叶状肿瘤、细胞性纤维腺瘤、假血管瘤样间质增生、肌纤维母细胞瘤等,再考虑其他间叶源性病变,方可有效避免误诊。







文章评论(0)