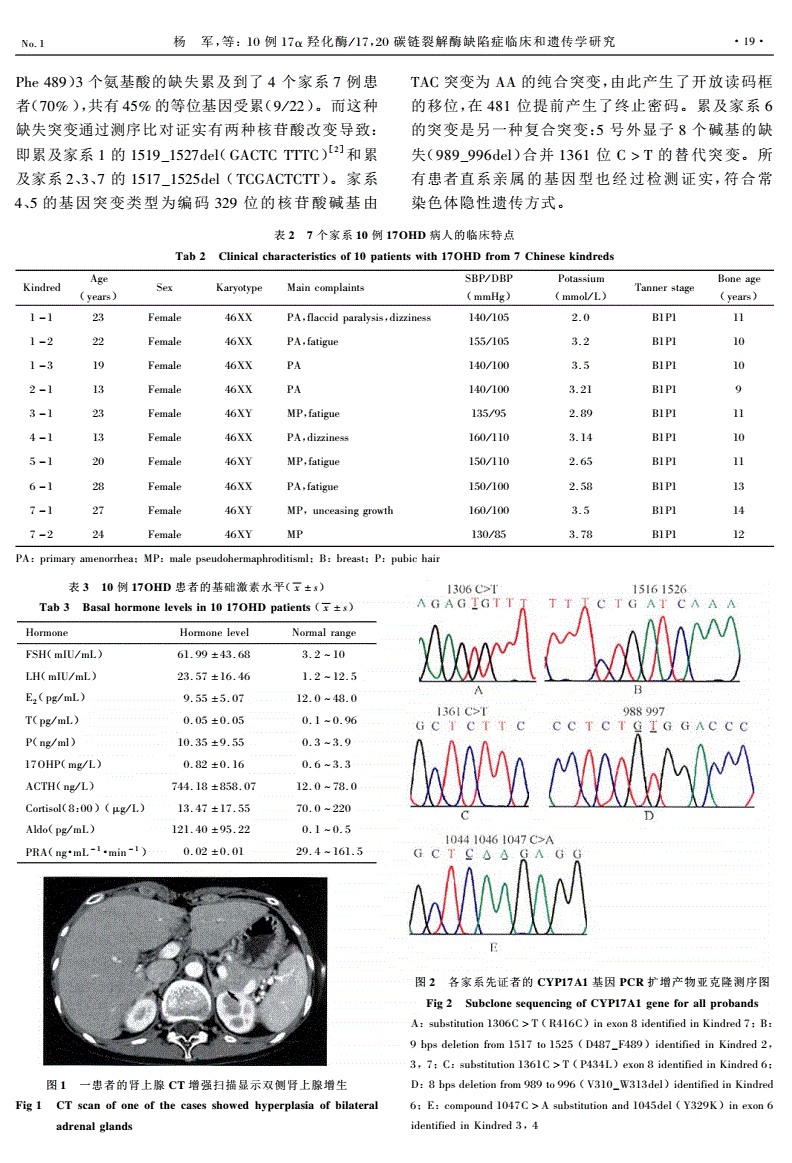
17羟孕酮(羟孕酮测定新生儿)
赵海建陈文祥 张传宝
17α-羟孕酮是人体内的一种内源性甾体激素,其水平升高主要见于先天性肾上腺皮质增生症(congenital adrenal hyperplasia,CAH),是CAH的筛查指标、治疗监测和特异性诊断指标,准确测定17α-羟孕酮在CAH的早期诊断和早期治疗中尤为重要。临床上检测17α-羟孕酮主要使用免疫学方法,由于17α-羟孕酮生理浓度低且人体内存在多种甾体激素干扰,免疫学测定17α-羟孕酮常存在特异性低、假阳性率高等问题。液相色谱串联质谱法(liquid chromatography tandem mass spectrometry,LC-MS/MS)精密、特异,逐渐应用于17α-羟孕酮临床检测,但多为实验室自建方法,各实验室的方法操作流程并不统一。目前在国内17α-羟孕酮尚缺乏可获得的有溯源性的校准品,免疫学方法和质谱法均存在着校准品不统一的情况。以上这些问题给17α-羟孕酮的准确测定和CAH的正确临床决策带来了极大的困难。因此,亟需完善17α-羟孕酮的参考系统,加快推动17α-羟孕酮的标准化工作。
一、17α-羟孕酮检测的临床意义
CAH是一种罕见的新生儿遗传代谢病,其发病率为1/18 000~1/14 000。严重CAH患儿会出现失盐危象,可能导致患儿休克甚至死亡[1,2]。CAH潜在临床后果严重,早诊断早治疗能降低其发病率和死亡率,改善患儿的临床结局。90%以上的CAH病例与21-羟化酶缺乏有关,其中静脉注射促肾上腺皮质激素后检测血清17α-羟孕酮(ACTH激发试验)被明确为21羟化酶缺乏症激素诊断的金标准[1,2]。国际内分泌学会发表的CAH诊疗指南和国内CAH新生儿筛查共识明确建议使用17α-羟孕酮干血片检测作为CAH的筛查指标[1,2,3]。若筛查阳性,患儿可通过再次检测血清中的17α-羟孕酮来进行确诊。据国内先天性肾上腺皮质增生症21羟化酶缺乏症诊治共识所述,血清17α-羟孕酮的基础值可指导CAH的分型和诊断[4]。同时17α-羟孕酮还可用于CAH的治疗监测,CAH患儿需定期监测血17α-羟孕酮来调整治疗药物剂量[3]。17α-羟孕酮还可作为其他内分泌疾病的辅助诊断指标,如多囊卵巢综合征、女性不育症等。

二、17α-羟孕酮的代谢途径和生理理化性质
17α-羟孕酮主要产生于肾上腺皮质,部分产生于性腺,如卵巢黄体。17α-羟孕酮生理浓度较低,在体内可作为前体物质合成其他的内源性甾体激素(如雄激素、皮质醇等),其代谢和合成途径如图1所示。在健康人群中,17α-羟孕酮由孕酮或17α-羟孕烯醇酮转换而来,在21-羟化酶的作用下转换成11-脱氧皮质醇,再进一步合成皮质醇。同时少量17α-羟孕酮也可在17, 20-裂解酶的作用下合成雄烯二酮,进而合成睾酮和二氢睾酮[5]。在21-羟化酶缺陷的CAH患儿中,17α-羟孕酮无法转换成足量的皮质醇,低水平的皮质醇刺激肾上腺腺体增生和代偿性分泌类固醇,从而导致更多的17α-羟孕酮在体内积聚。大量累积的17α-羟孕酮使其向雄烯二酮转化增多,生成睾酮[2,4,6]。17α-羟孕酮也可通过还原产物,以雄甾烷二醇为中间底物生产二氢睾酮[7,8](“后门”途径)。
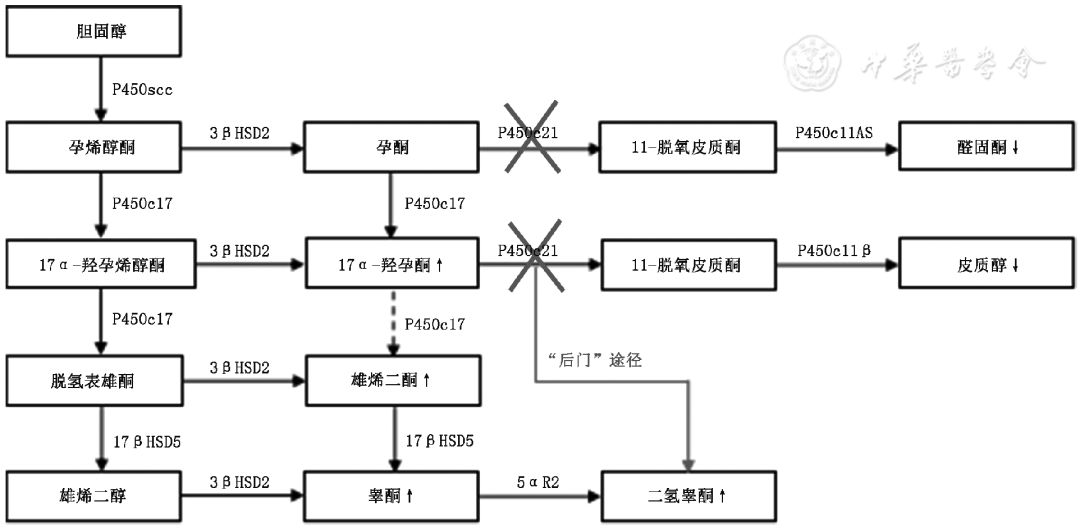
图1健康人群和CAH患儿肾上腺皮质激素的代谢和合成
17α-羟孕酮(C21H30O3)相对分子质量为330.46,微溶于水,易溶于甲醇、乙醇、氯仿等有机试剂,在代谢通路上有众多结构类似物[9]。17α-羟孕酮生理浓度较低,在成年男性和女性水平不高于2.85 ng/ml。新生儿出生时下丘脑-垂体-肾上腺轴和下丘脑-垂体-性腺轴被激活,肾上腺类固醇水平较高,足月婴儿的17α-羟孕酮水平可达到6.30 ng/ml。而由于疾病和压力,早产儿的17α-羟孕酮升高更加明显,高达10 ng/ml[10]。在人体血液循环中17α-羟孕酮与皮质类固醇结合球蛋白和白蛋白均可结合,而总17α-羟孕酮是临床上的主要检测指标。
三、17α-羟孕酮的实验室检测进展
17α-羟孕酮的临床常规检测方法主要为免疫学方法、气相色谱质谱(gas chromatography mass spectrometry,GC-MS)和LC-MS/MS。
(一)免疫学方法
大多数类固醇激素的测定方法都是基于免疫分析法,其中放射免疫法(radioimmunoassay,RIA)是最早应用于检测17α-羟孕酮的免疫学方法。RIA操作繁琐,试剂盒有效时间短,且具有放射性污染[11]。其他免疫分析法,包括酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA),荧光酶免疫分析法(enzyme-linked fluorescent immunoassay,ELFIA),化学发光免疫分析(chemiluminescence immunoassay,CLIA)和时间分辨荧光免疫分析法(time-resolved fluoroimmunoassay,TRFIA)等由于无放射污染,操作简便,更适合高通量的样本分析的优势,已逐渐取代RIA。但是基于抗原抗体反应的免疫学方法缺乏特异性,其检测结果的可靠性一直饱受质疑。尤其是新生儿血浆中的类固醇单硫酸酯(如17羟孕烯醇酮硫酸盐和15β羟基化合物等)易与17α-羟孕酮的抗体发生交叉反应,造成早产儿和重症新生儿17α-羟孕酮水平假性升高[12,13,14]。尽管一些免疫检测采用液液萃取的前处理来减少干扰,但该种方式没有内标校正,难以保证每个样本提取回收率相同,并且仍然容易受到其他内源性类固醇的干扰[15]。
(二)GC-MS
GC-MS于20世纪60年代首次引入,并在20世纪80年代进行了改进,因其具有高选择性,高准确度和高灵敏度而被普遍认为是类固醇激素检测的金标准[16]。Shimizu等[17]在1988年建立了一个检测血浆中的17α-羟孕酮的GC-MS方法。血浆样本在经过二乙醚两次液液萃取后,使用三甲基硅基咪唑试剂进行衍生,精密度为0.8%~4.9%。与免疫分析法相比,GC-MS的优势还在于可以同时测定多种类固醇激素。1992年,Wudy等[18]建立了同时测定包括17α-羟孕酮6种血浆甾体激素的GC-MS法。该方法需要1~2 ml的血浆,通过七氟丁酸酐衍生、液液萃取和凝胶色谱柱纯化,在去除血浆脂质同时减少了极性类固醇的干扰,其精密度和相对回收率分别为3.6%~3.8%和92.5%~100.2%。在此基础上,Homma等[19]简化了样本前处理,仅需0.1 ml的血清即可达到3%的精密度和98%的相对回收率。而在Magnisali等[20]使用的衍生方案中,血清类固醇的羟基和羰基同时发生硅基化,分别生成三甲基硅醚和烯醇硅基衍生物。该衍生过程仅需35 min,在节约了反应时间的同时,17α-羟孕酮的检测限低至0.05 ng/ml。

(三)LC-MS/MS
20世纪80年代末,电喷雾电离源的引入实现了液相色谱仪和质谱仪的连接,为LC-MS/MS在临床的应用开辟了方向[21]。而LC-MS/MS在多反应监测模式下的MS/MS分析使检测方法具有更高的特异性,同时液相色谱的多功能性可以缩短分析时间,提高检测通量。过去20年内,LC-MS/MS法在17α-羟孕酮的临床检测中逐步得到应用,表1总结了近年来文献报道的17α-羟孕酮LC-MS/MS检测方法[22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37]。如表1所示,2005年Turpeinen等[29]建立了LC-MS/MS方法检测17α-羟孕酮,取0.5 ml的血清使用两次液液萃取作为前处理,检测限为1 nmol/L(0.3 ng/ml)。2016年Gervasoni等[35]建立了一个应用自动化技术进行样本前处理的超高效液相色谱串联质谱检测方法,仅需0.1 ml的血清即可达到0.02 ng/ml的定量限,批内精密度低至3.4%~5.3%。该方法出色的性能得益于当前样本前处理技术和LC-MS/MS检测系统的飞速发展,同时17α-羟孕酮LC-MS/MS的检测性能也与检测样本类型密切相关。
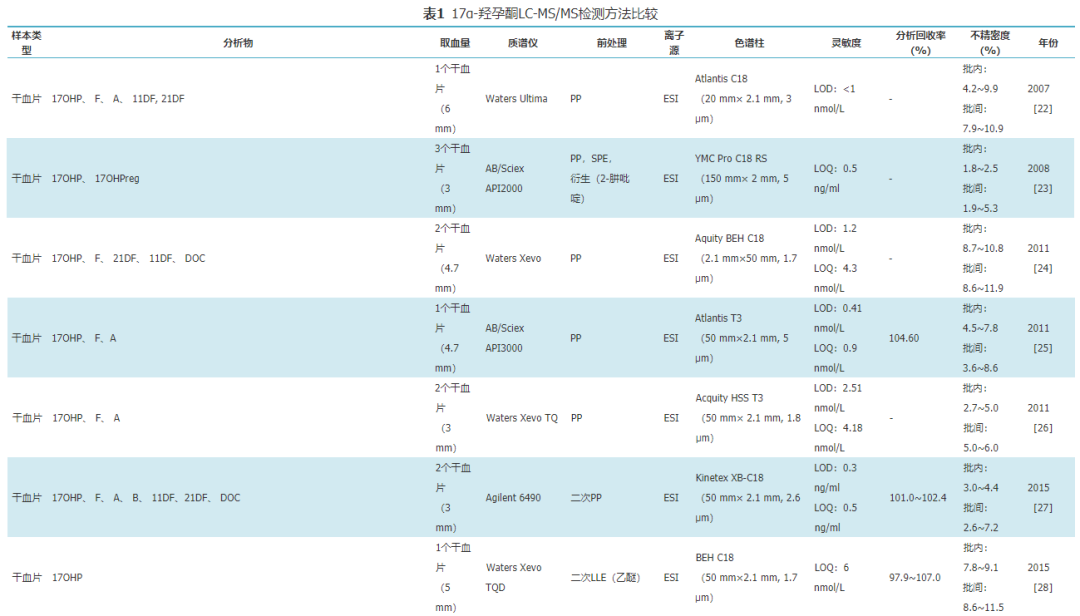
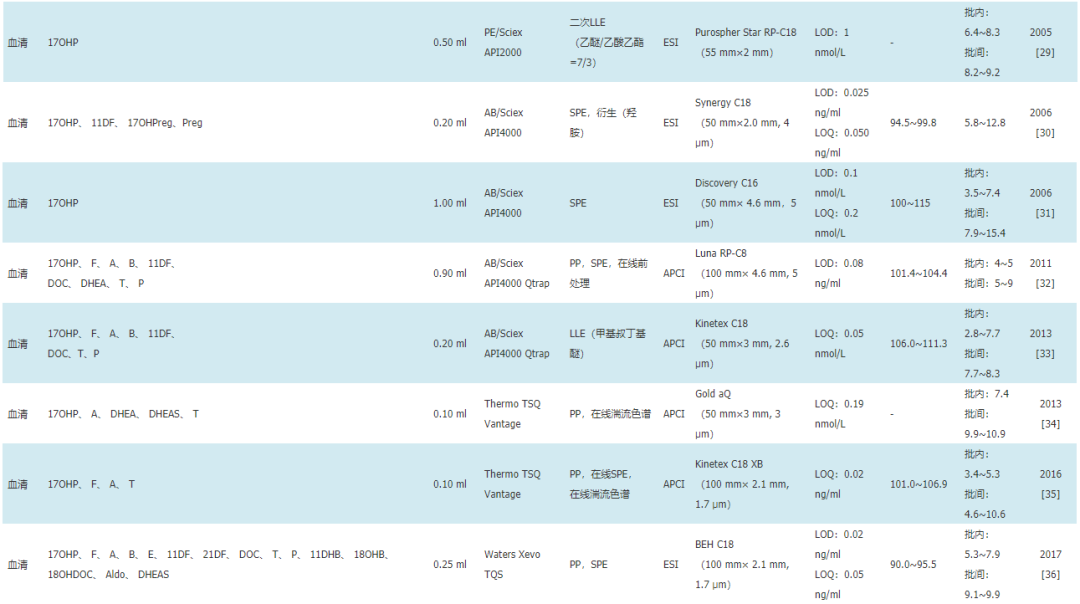

表117α-羟孕酮LC-MS/MS检测方法比较
1. LC-MS/MS的样本类型:LC-MS/MS灵敏度高,可以用来检测不同基质的17α-羟孕酮,如唾液、干血片及血清等。唾液中含有大部分的甾体激素且与血清的激素水平有一定相关性。相较于检测血液样本,唾液的收集更加经济方便且属于无创检查,适合治疗期间需要长期监测17α-羟孕酮水平的新生儿患者[38]。Gaudl等还将头发作为样本检测甾体激素[39]。在临床实践中,检测17α-羟孕酮的样本通常为血清或者干血片,而LC-MS/MS检测干血片的17α-羟孕酮在国际上通常作为CAH的二级筛查手段[1,2]。干血片需要的血量小,操作简便,易被家长接受。但干血片的制备与血片大小、厚薄均匀程度、红细胞压积等有关,干血片的制备质量也难以得到保证。研究表明,用LC-MS/MS方法分别检测了干血片和血清的17α-羟孕酮,发现干血片的精密度和回收率不及血清,这可能与干血片基质效应更高有关[40]。LC-MS/MS检测血清中的17α-羟孕酮能更真实地反映体内17α-羟孕酮水平,同时也是CAH的确诊手段。
2. LC-MS/MS的样本前处理:LC-MS/MS的样本前处理通常分为传统的离线前处理(手工法)和在线前处理(自动化法)。离线前处理包括衍生、蛋白沉淀(protein precipitation,PP)、液液萃取(liquid liquid extraction,LLE)和固相萃取(solid phase extraction,SPE)等。不同于GC-MS中的衍生,LC-MS/MS中的衍生主要用来加强待测物的电离效率,特别是生理浓度不高的17α-羟孕酮。羟胺和2-肼吡啶是17α-羟孕酮LC-MS/MS检测中常用的衍生试剂,可提高检测的灵敏度[23,30]。由于衍生操作复杂,且衍生试剂大多对人体具有毒性,这种方式逐渐被其他前处理方式取代。蛋白沉淀不能去除血清基质中的杂质,可能会造成检测系统污染和电离效率下降,但由于操作简便,通常应用于干血片LC-MS/MS的前处理。LLE去除杂质的能力更强,常用于提取17α-羟孕酮的萃取试剂有乙醚和甲基叔丁基醚等[28,29,33,37]。LLE需要耗费大量的有机溶剂,但成本低廉。SPE的填料有反相吸附剂和反相离子交换混合吸附剂等。由于17α-羟孕酮非极性强,反相的SPE柱可满足要求,而混合模式吸附剂具有更高的选择性,能将基质处理得更干净。SPE简单易行且提取率高,已逐渐应用于检测17α-羟孕酮的样本前处理中[30,31,32]。但SPE较高的成本使其在常规临床实验室的应用中有一定限制。
离线前处理分析时间长,且对操作人员的水平要求较高。随着技术的发展,自动化在前处理过程中得以体现。在线样本前处理技术便是近年来开发的自动化技术,包括湍流色谱技术和在线SPE等。湍流色谱是指将高速线速度与大颗粒相结合产生湍流,化合物分子可以扩散到涡轮流固定相的颗粒孔中,而大分子则被排除和丢弃,从而减少检测的干扰和基质效应[34,35]。而在线SPE通过将待测物质保留在线萃取柱中,洗去未结合的杂质后,切换阀门将待测物质洗脱至分析柱[35]。与湍流色谱利用色谱柱填料孔径实现区分不同,在线SPE是利用固相填料基团与待测物的结合实现分离。在线前处理技术可以降低人为错误的风险,在不损失灵敏度和选择性的情况下让方法更稳健,同时大大提高了检测通量[32,34,35]。
3.液相色谱串联质谱的检测系统:高效液相色谱是目前临床实验室LC-MS/MS检测中最常用的液相设备。而超高效液相色谱(ultra performance liquid chromatography,UPLC)耐压高,配套的色谱柱粒径小,能在保证色谱分离率的前提下缩短分离时间,同时UPLC中缩窄的峰形可以提高17α-羟孕酮的灵敏度。UPLC系统的成本比现有LC方法高10%~20%,但UPLC在应用于干扰众多的痕量待测物(如甾体激素等)临床检测中显示出了优越的性能[24,26,35,36]。微流液相色谱(microflow liquid chromatography,micro LC)是指使用较低流速或较小内径色谱柱的液相色谱,相较传统的LC,低流速进行17α-羟孕酮LC-MS/MS检测可以减少流动相的消耗,降低对电离源污染,同时可以提高灵敏度[41,42]。在复杂基质的分析中,单一分离模式很难提供足够的分离性能,而二维液相色谱(two dimensional liquid chromatography,2D LC)通过将两个分离机制不同且相互独立的色谱柱串联,获得了更快的分析速度和更高的色谱分离能力。Karvaly等[43]将16种甾体激素在2D LC-MS/MS上进行检测,所有分析物在2.3~4.6 min间洗脱,其中17α-羟孕酮的精密度为2.8%~15.0%[43]。平行液相色谱则是使用两个相同的独立色谱柱,在一个样本运行时注入新样本,从而有效利用冲洗平衡时间来提高分析速度,具备高通量分析的潜力。Søeborg等[34]将该技术应用至17α-羟孕酮的LC-MS/MS分析,10.75 min检测两个样本,可以在短时间内实现大批量样本检测。
随着质谱技术的日益发展,不仅提升了17α-羟孕酮LC-MS/MS检测的分析性能,还为同时准确检测血清中多种类固醇提供了可能性(表1)。同时测定多种血清类固醇需要兼顾多种分析物的特性,通常使用大气压化学电离源(atmospheric pressure chemical ionization,APCI),其气相离子化的特点适合大多中等极性的类固醇,使其都能得到有效电离[32,33,34,35]。而电喷雾电离源(electrospray ionization,ESI)可使17α-羟孕酮灵敏度提高约2倍[37]。同时测定多种血清类固醇对检测方法性能要求更高,由于血清中类固醇大多为结构类似物,且与CAH相关的类固醇浓度区间跨度大(皮质醇生理浓度约为11-脱氧皮质酮的1 000倍),方法的选择性、灵敏度和精密度都面临着更大的挑战。离子淌度差分质谱分离技术(differential ion mobility spectrometry,DMS)给传统质谱增加了新的分离维度,DMS可以根据与空间结构特性相关的离子差分迁移率对待测物进行分离,从而提高检测类固醇激素的分析性能。应用DMS不仅可以降低背景噪声的干扰,简化样品制备,同时DMS分离和色谱分离相结合,能更好地实现同分异构体的分离。Ray等[37]建立的基于DMS技术的LC-MS/MS检测方法仅需一步液液萃取可同时测定5种血清类固醇,其17α-羟孕酮的检测限达到0.09 nmol/L,精密度可达到2.3%~3.9%。
四、17α-羟孕酮检测的标准化现状
目前国内外17α-羟孕酮的参考溯源体系尚未完善。澳大利亚国家计量研究所研制的17α-羟孕酮的纯度标准物质S041,认证质量分数98.7%,不确定度0.8%。该标准物质通过核磁共振、红外光谱、质谱等多种光谱技术进行了确认,并采用质量平衡法和定量核磁共振技术进行纯度定值,目前已被收录至检验医学溯源联合委员会(Joint Committee for Traceability in Laboratory Medicine,JCTLM)列表中[44,45]。国内中国计量科学研究院也研制出了17α-羟孕酮的纯度标准物质GBW09220,认证质量分数99.3%,不确定度0.2%[46]。JCTLM列表尚未收录任何17α-羟孕酮的血清基质标准物质[44]。而中国计量科学研究院研制的人血清17α-羟孕酮标准物质(GBW09829和GBW09830),标准浓度分别为0.51和1.65,相对不确定度分别为3.9%和2.0%,以超高效液相色谱-同位素稀释质谱法进行定值测量,基质均为新鲜冰冻血清[47],但目前无法获取。JCTLM收录的17α-羟孕酮的参考方法有且仅有一个,为梅奥医院参照Wudy等[48]的同位素稀释ID/LC-MS/MS(isotope dilution liquid chromatography tandem mass spectrometry,ID/LC-MS/MS)提出的血清17α-羟孕酮参考方法。该方法采用乙酸乙酯三次萃取进行样本前处理,精密度为7.4%~12.0%,分析回收率为93.6%[44,48]。另外我国国家卫生健康委临床检验中心建立了一个基于ID/LC-MS/MS技术测定血清17α-羟孕酮的候选参考方法,该方法精密,准确,具有较高的灵敏度,能够满足血清17α-羟孕酮的准确定量[49]。
为了促进17α-羟孕酮检测的一致化与标准化,国家卫生健康委临床检验中心开展了17α-羟孕酮的室间质量评价(external quality assessment,EQA)项目,采用分组后实验室的稳健均值作为靶值。据2019年血清17α-羟孕酮EQA的回报结果,总共36个参与实验室,其中9家实验室采用LC-MS/MS分析法,27家实验室采用免疫学方法(CLIA,21家;ELISA,3家;RIA,2家;均相酶免疫法,1家)。LC-MS/MS分析法的实验室间变异为7.40%~10.86%,免疫学分析法的实验室间变异为30.4%~42.7%。同时基于血清17α-羟孕酮候选参考方法赋值并具有互通性的质评材料[44],国家卫生健康委临床检验中心于2019年也开展了血清17α-羟孕酮正确度验证调查计划。5家参与实验室均采用LC-MS/MS检测方法,在两个浓度水平上其相对偏倚分别为-5.38%~38.79%和-11.84%~45.13%。2018年,欧洲科技合作工作组对17个国家44个使用质谱技术检测血清17α-羟孕酮的实验室展开了问卷调查。调查发现不同实验室的操作流程、校准品不统一,其报告的参考区间也相差较大,可能是造成17α-羟孕酮LC-MS/MS检测方法结果不一致的原因[50]。由此可见,目前国内外不同实验室、不同方法间17α-羟孕酮检测结果仍缺乏准确性与可比性。
五、总结与展望
17α-羟孕酮的实验室检测在CAH筛查与诊疗中至关重要。其中免疫学方法和LC-MS/MS是实验室检测17α-羟孕酮的常用方法,有各自的优势和劣势。免疫学检测所需仪器成本相对较低,自动化程度高,广泛应用于临床实验室。但免疫学方法易发生交叉反应,假阳性高,并且目前市面上的免疫试剂盒不统一,校准品缺乏溯源性。免疫学方法的这些问题使得免疫法的实验室内、不同实验室间变异系数大,检测结果不可比。LC-MS/MS具有高选择性、高精密度和高灵敏度的优势,还可以同时检测多种CAH相关的甾体激素,更适合低生理浓度的17α-羟孕酮的实验室测定。而随着自动化技术在LC-MS/MS中的应用,以及LC-MS/MS在临床实验室的普及,使用LC-MS/MS来对17α-羟孕酮等痕量物质进行高通量检测仍将是国内外临床实验室的重要发展方向。但17α-羟孕酮LC-MS/MS检测大多为实验室自建方法,商品化的试剂盒尚未成熟,且方法间缺乏统一的操作流程和校准品。这造成了LC-MS/MS方法不同实验室间的检测结果同样缺乏准确性和可比性。17α-羟孕酮的检测结果互认及标准化工作道阻且长,需要国内专家学会、参考实验室、临床实验室及试剂厂商的共同努力:临床质谱专家须达成共识,制定17α-羟孕酮质谱检测的专家共识和临床指南,指导临床质谱实验室建立统一规范的操作流程;标准化机构应完善17α-羟孕酮的参考溯源体系,提供满足临床需求且具有互通性的基质标准物质,加快开展标准化工作;临床实验室、试剂厂商应仔细评价并验证检测方法的性能,重视17α-羟孕酮测定的量值溯源,同时积极参与EQA计划和基于正确度的EQA计划,监测并持续改进17α-羟孕酮的检测质量,从而为临床提供准确的17α-羟孕酮检测结果,以助临床医生作出正确的临床决策。为实现17α-羟孕酮实验室检测的可比互认,准确测定17α-羟孕酮及开展17α-羟孕酮的标准化工作势在必行。
利益冲突所有作者均声明不存在利益冲突
选自中华检验医学杂志, 2019,43(12)







文章评论(0)