舌根乳头状瘤(舌头根乳头状瘤)
文章摘要
国际癌症研究机构(International Agency for Research on Cancer,IARC)于2021年5月出版了《WHO胸部肿瘤分类(第5版)》。与2015年出版的《WHO胸部肿瘤分类(第4版)》相比,《WHO胸部肿瘤分类(第5版)》变更了主要章节的框架,新增和调整了部分疾病的命名和分类,并充实了流行病学、病因学、组织病理学和分子遗传学等相关内容。现就《WHO胸部肿瘤分类(第5版)》中肺肿瘤分类变化较大的内容予以简要介绍。
引用本文:李媛,谢惠康,武春燕. WHO胸部肿瘤分类(第5版)中肺肿瘤部分解读[J]. 中国癌症杂志, 2021, 31 (7): 574-580.
国际癌症研究机构(International Agency for Research on Cancer,IARC)于2021年5月出版了《WHO胸部肿瘤分类(第5版)》(以下简称新版)[1]。与2015年出版的《WHO胸部肿瘤分类(第4版)》(以下简称旧版)[2]相比,新版对主要章节的框架进行了变更,新增和调整了部分疾病的命名和分类,并充实了流行病学、病因学、组织病理学和分子遗传学等相关内容。
新版更新内容
新版增加了一些系统性更新内容:① 新版中除保留原ICD-O编码外,同时引入了ICD-11编码,ICD-11编码由WHO于2018年6月18日最新发布,替代了原ICD-10编码。② TNM分期更新为2017年国际抗癌联盟(Union for International Cancer Control,UICC)颁布的第8版肺肿瘤TNM分期[3]。③ 每个章节增加了基本的和理想的诊断标准,便于读者更好地掌握诊断要点。④ 更加强调多学科诊疗模式,并更新了临床、影像、分子及治疗方面的内容。⑤ 新增了肺肿瘤类型,腺瘤中新增细支气管腺瘤/纤毛黏液结节乳头状肿瘤,其他上皮性肿瘤中新增胸部SMARCA4缺失的未分化肿瘤,涎腺肿瘤中新增玻璃样变透明细胞癌。
2
肺肿瘤目录的调整(表1)
新版肺肿瘤目录的调整主要体现在以下几个方面:① 新版肺肿瘤目录编排按照组织来源的前驱病变-恶性肿瘤的顺序,例如,旧版中的肺腺癌、肺鳞状细胞癌、肺神经内分泌肿瘤目录下的非典型腺瘤样增生/原位腺癌、鳞状上皮不典型增生/原位鳞状细胞癌、弥漫性特发性肺神经内分泌细胞增生,新版中均调整至对应肿瘤目录中的前驱病变处,体现了同一组织来源的肿瘤从异型增生-原位-浸润性病变的进展过程,而新版中关于前驱病变的诊断标准及ICD-O编码均无变化。② 新版目录中部分肿瘤的位置有所调整,例如,旧版中归入其他或未分化癌目录下的淋巴上皮癌,新版中归入鳞状细胞癌;旧版中肺间叶性肿瘤目录下的肌上皮瘤/肌上皮癌,新版中归入肺原发涎腺肿瘤;旧版中异位肿瘤中删除了生殖细胞肿瘤和肺内胸腺瘤;旧版中肺间叶性肿瘤目录下的炎性肌成纤维细胞瘤和滑膜肉瘤,新版中均归入胸部间叶性肿瘤章节。

3

肺癌小活检及细胞学标本诊断流程及诊断术语
在局部晚期或转移性肺癌中,约有70%的病例是通过小活检及细胞学检查确诊的,旧版对小活检和细胞学诊断做了一些规定。除原有小活检标本诊断流程及术语外,新版中新增了“类癌,非特指型”和“神经内分泌癌,非特指型”的诊断术语。由于肺癌分子病理学诊断及靶向治疗药物的进展,肺癌小活检标本除必要的H-E染色切片及免疫组织化学染色外,应尽可能地将组织保留给分子病理学诊断,并对分子病理学诊断需要的组织内存活肿瘤百分比进行记录。细胞学诊断中强调细胞块的重要性,如大量胸水时应将满足诊断外的标本制成细胞块,以便进行免疫组织化学及分子学检测。
4
肺上皮性肿瘤分类
4.1腺瘤
腺瘤中除原有的硬化性肺细胞瘤、肺泡腺瘤、乳头状腺瘤、黏液囊腺瘤、黏液腺腺瘤外,新增了支气管腺瘤/纤毛黏液结节乳头状肿瘤。支气管腺瘤/纤毛黏液结节乳头状肿瘤是一种肺外周良性肿瘤,由双层细支气管亚型上皮组成,伴连续的基底细胞层。肿瘤发生于周围细支气管,与近端支气管无关。BRAF突变为其最常见的驱动基因,偶见表皮生长因子受体(epidermal growth factor receptor,EGFR)、KRAS、HRAS和间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)突变。肿瘤直径为2~45 mm,但通常在5~15 mm之间。组织学上肿瘤呈乳头状或扁平(腺性)结构,其由腔面细胞及基底细胞构成,腔面细胞由黏液细胞、纤毛细胞(近端型细支气管腺瘤/经典型纤毛黏液结节乳头状肿瘤)或类似于Ⅱ型肺泡上皮、Clara细胞(远端型细支气管腺瘤/非经典型纤毛黏液结节乳头状肿瘤)构成。肿瘤中可见微乳头簇状结构及轻微的跳跃性播散,不应作为恶性的判定标准。近端型和远端型形态学特征可有重叠过渡。远端型腔内细胞可表达TTF-1,而近端型则为阴性或弱阳性。基底细胞P40和(或)CK5/6可呈阳性。冷冻切片和小活检中诊断具有挑战性,特别当远端型支气管腺瘤的腔面细胞缺乏纤毛时,诊断将变得更为困难,此时P40和CK5/6免疫染色将有助于诊断。鉴别诊断包括支气管乳头状瘤、细支气管化生等。
4.2前驱腺体病变
前驱腺体病变包括非典型腺瘤样增生/原位腺癌,新版对其的诊断标准及ICD编码均未改变,由于WHO分类目录的整体调整,非典型腺瘤样增生/原位腺癌目录位置由浸润前病变调整为前驱腺体病变。
4.3腺癌
新版主要对肺腺癌进行了以下内容的更新:
⑴ 浸润性非黏液性腺癌以5%为标尺记录不同亚型,不再要求归类为某亚型为主的腺癌。
⑵ 腺泡型腺癌的诊断中对筛状腺癌进行了更为详细的描述,筛状腺体被描述为缺乏间质且具有背对背相互融合的肿瘤性腺体。筛状腺体预后更差并与腺癌分级系统(详见后述)相关。
⑶ 乳头型腺癌的诊断中强调应与由手术造成的贴壁型腺癌肺泡间隔断裂及肺实质塌陷造成的假乳头结构相鉴别。
⑷ 微乳头型腺癌除延续旧版诊断标准外,新版纳入了一种新的丝状微乳头生长模式,该模式呈纤细、蕾丝样,至少堆积有3个瘤细胞高度的狭长肿瘤细胞,肿瘤内缺乏纤维血管轴心。在计算百分比时,当微乳头周围围绕腺管、乳头、贴壁形态时,该区域应计入微乳头,不再纳入其他亚型。
⑸ 强调了 浸润性腺癌中浸润的定义 :① 除贴壁成分以外的亚型(包括常见的腺泡、乳头、微乳头、实体型腺癌及少见的浸润性黏液、胶样、胎儿、肠型腺癌)。② 伴有纤维母细胞灶。③ 血管、胸膜侵犯。④ 气腔播散。强调浸润性腺癌中浸润与非浸润的区别与第8版TNM分期仅将肿瘤浸润区域纳入T分期计算有关。
⑹ 新版进一步肯定了 气腔播散 的预后价值,同时也强调应与人工假象进行鉴别,人工假象具有的特点包括:① 随机或边缘杂乱的肿瘤细胞簇通常分布于组织切片边缘或切片外。② 肿瘤边缘及远处的气腔内缺乏连续性的肿瘤细胞分布。③ 肿瘤细胞簇呈锯齿状边缘分布。④ 播散的细胞具有肺泡细胞或支气管细胞等良性细胞学特点。⑤ 从肺泡壁上剥落的线条状细胞。
⑺ 在肺癌的免疫组织化学分析中强调TTF-1 SPT24克隆号具有更强的敏感性,而8G7G3/1克隆号具有更强的特异性,同时强调CK7在腺癌的诊断中不具有特异性。
⑻ 更新了根治性手术切除肺标本浸润性非黏液性肺腺癌的国际肺癌研究学会(International Association for the Study of Lung Cancer, IASLC)新分级系统。旧版分类中浸润性腺癌依据主要亚型分为良好预后的贴壁型为主腺癌,中等预后的腺泡及乳头型为主腺癌,差预后的微乳头及实体型为主腺癌。 新版分类中根据主要亚型及高于20%的高级别成分 [包括实性、微乳头、筛状或复杂腺体成分(融合腺体及促结缔组织增生性间质内浸润的单个细胞)] 将腺癌分为3组 (表2),通过此三级分层系统,其预后预测价值不但优于主要组织学亚型的分级系统,并且较纳入核分裂、核分级、细胞学分级、气腔播散和坏死的训练模型更优。 但IASLC新分级系统不适用于浸润性黏液腺癌 。

⑼ 鉴别多原发或肺内转移性腺癌可根据是否含有贴壁型成分加以鉴别。
⑽ 随着近年来分子检测及治疗药物的进展,除旧版WHO中的EGFR、ALK、KRAS基因外,新版增加了ROS1/RET重排、MET14跳跃突变、BRAF V600E基因、程序性死亡[蛋白]配体-1(programmed death ligand-1,PD-L1)表达及肿瘤突变负荷等治疗反应相关检测项目。
⑾ 黏液腺癌 的免疫组织化学诊断方面新增了GATA6,该标志物可在黏液腺癌中表达,但尚缺乏特异性。在分期方面黏液腺癌无需像非黏液腺癌一样去除贴壁型非浸润区域,而需要将肿瘤的整体直径计算在内。
⑿ 肠型腺癌 的英文名由enteric adenocarcinoma调整为enteric-type adenocarcinoma,鉴别诊断中除原有的CK7、CK20、CDX-2和villin等几个指标外,新增MUC2和HNF4a。值得注意的是,STAB2和cadherin 17等肠癌标志物很少在肺肠型腺癌中表达。
4.4鳞状细胞前驱性病变
鳞状细胞前驱性病变包含鳞状上皮不典型增生/原位鳞癌,新版对其诊断标准无任何改变,但由于WHO分类目录的调整,其目录位置由原来鳞状细胞癌子目录下的浸润前病变调整为单独目录的鳞状细胞前驱病变。
4.5鳞状细胞癌
新版中鳞状细胞癌分为角化型鳞状细胞癌、非角化型鳞状细胞癌及基底细胞鳞状细胞癌3个亚型。另一个重要更新为 淋巴上皮癌 (原名淋巴上皮瘤样癌,旧版中归入其他或未分化癌目录下) ,新版中归入鳞状细胞癌, 并认为>90%的亚洲病例与EB病毒有关 ,而在欧美人群中,其与EB病毒的相关性较低。在分子病理学上,发现鳞状细胞癌也有EGFR基因突变及ALK基因融合的可能性。肺鳞状细胞癌需要与肺原发性涎腺肿瘤、SMARCA4缺失的未分化肿瘤、NUT癌、转移性尿路上皮癌及胸腺癌等肿瘤鉴别。
4.6大细胞癌
大细胞癌为未分化非小细胞癌 ,诊断时形态学上必须先排除鳞状细胞癌、腺癌和小细胞癌,免疫组织化学分析及黏液染色不支持鳞样及腺样分化。大细胞癌需要手术切除标本充分取材后才能诊断,非手术切除标本及细胞学标本不足以诊断大细胞癌。新版中诊断大细胞癌依然需要进行充分的鉴别诊断,且需进一步排除SMARCA4缺失的未分化肿瘤。大细胞癌预后及预测因素方面与腺癌相似,新版中强调靶向治疗相关基因突变及PD-L1表达的检测。
4.7肉瘤样癌
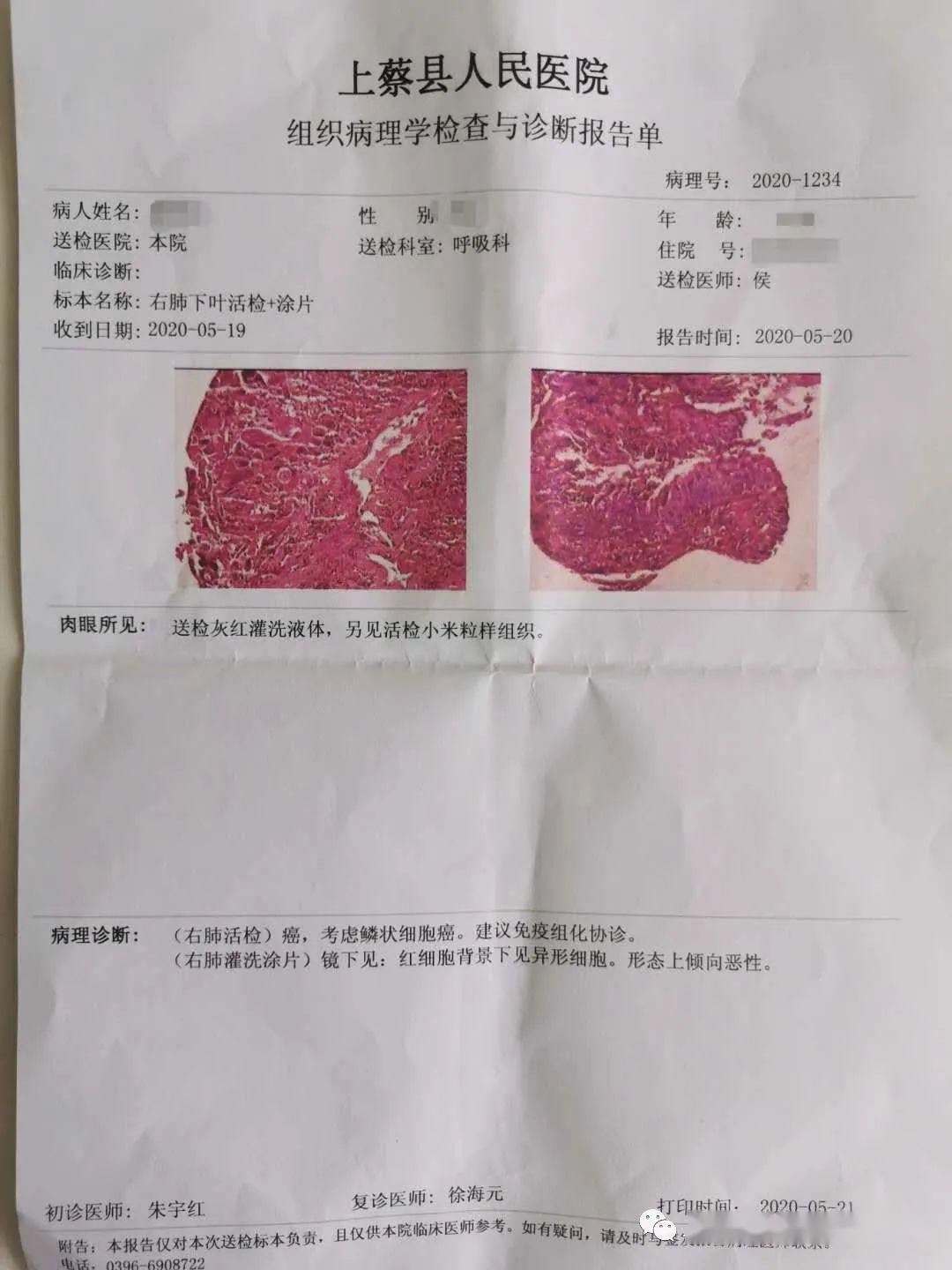
新版中将肉瘤样癌分为多形性癌、肺母细胞瘤及癌肉瘤3个独立的疾病单独列出,而多形性癌、巨细胞癌及梭形细胞癌归属为多形性癌下的3个亚型,在多形性癌的鉴别诊断中GATA3弥漫性强阳性表达更支持肉瘤样间皮瘤/促结缔组织增生型间皮瘤的诊断,含有MET14跳跃突变的患者可能从相应靶向治疗中获益。
4.8其他上皮性肿瘤
其他上皮性肿瘤包括NUT癌,肺NUT癌与纵隔NUT癌无法鉴别。另外增加了胸部SMARCA4缺失的未分化肿瘤,SMARCA4(BRG1)是SWI/SNF染色体重塑复合体的一个亚单位。该肿瘤具有高度恶性生物学行为(中位生存时间仅4~7个月),患者通常为年轻至中年男性吸烟者。组织学上该类肿瘤由弥漫、失黏附性、大而圆的上皮细胞组成,肿瘤细胞的细胞质丰富,空泡状核,核仁明显。细胞核相对一致,偶有轻-中度异型性,肿瘤中可局灶性出现横纹肌样细胞,小标本中不常见,同时较易出现核分裂象及坏死。罕见表现包括梭形、黏液变、硬化、肺泡样、透明细胞变。大部分患者无明确上皮样分化特征(如腺体、乳头、角化),但约5%的患者可出现普通的非小细胞肺癌(non-small cell lung cancer,NSCLC)组织学特征。免疫组织化学检测大部分典型病理学表现为SMARCA4(BRG1)表达完全缺失,约有25%的病理学表现为SMARCA4染色弥漫性的染色减弱,而非完全缺失。SMARCA2(BRM)染色常伴随缺失,SMARCB1(INI1)染色未缺失。许多病例可伴有CD34、SOX2、SALL4和Syn阳性,P53常高表达,肿瘤细胞CK表达局灶或弱阳性,通常不会弥漫性表达Claudin4、p63、TTF-1、p40和WT-1。鉴别诊断方面由于肿瘤分化较差,需要与淋巴瘤、NUT癌、生殖细胞肿瘤、神经内分泌癌、大细胞癌、恶性黑色素瘤及恶性间叶源性肿瘤相鉴别,同时在非小细胞肺癌患者中约有5%的患者可出现SMARCA4缺失,可通过其典型的上皮样结构(如腺体形成)及免疫组化表达情况加以鉴别。另外胸外其他脏器亦可发生SMARCA4缺失的肿瘤,需注意与其他部位的转移肿瘤相鉴别。
4.9涎腺肿瘤
新版肺的涎腺型肿瘤除原有的多形性腺瘤、黏液表皮样癌、腺样囊性癌、上皮-肌上皮癌外,新增肺涎腺型玻璃样变透明细胞癌,该肿瘤是一种极为少见的涎腺型低度恶性肿瘤,起源于气管、支气管黏膜下小涎腺,临床常引起阻塞性症状,肿瘤呈惰性生长,几乎不复发。该肿瘤与涎腺发生的玻璃样变透明细胞癌的组织病理学形态及分子遗传学改变相似。组织学表现为黏液、玻璃样变纤维间质的背景下浸润的瘤细胞排列成条索、小梁、巢状,瘤细胞的细胞质常呈透明或嗜酸性。瘤细胞表达上皮标记物(AE1/AE3、EMA、CK7、p63和p40等),一般不表达肌上皮标志物(S-100和SMA),亦不表达TTF-1和NapsinA。分子遗传学上主要为EWSR1-ATF1融合,少数为EWSR1-CREM。
肺神经内分泌肿瘤
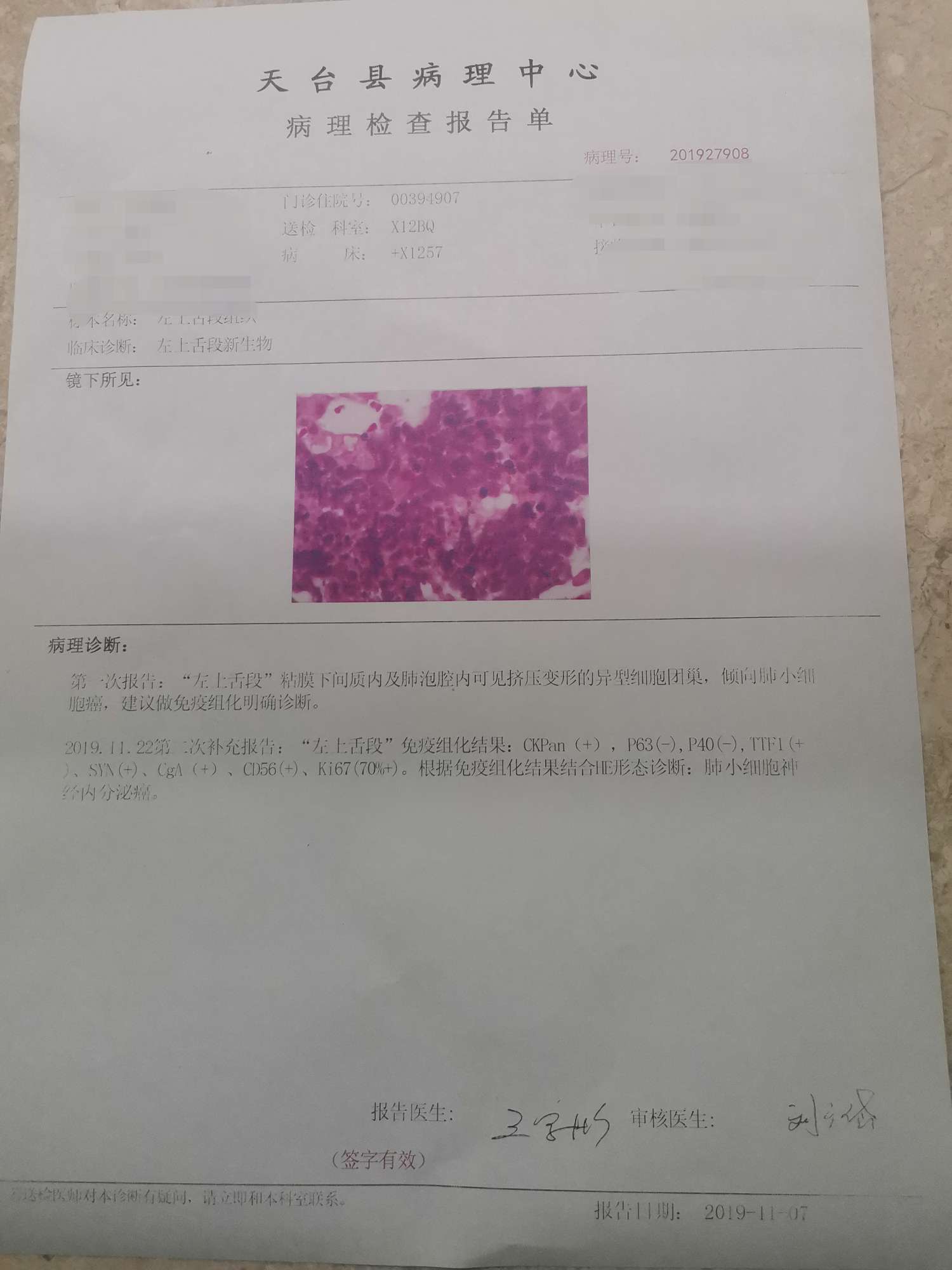
肺神经内分泌肿瘤是一个独特的肿瘤亚群,具有特定的组织学形态、超微结构、免疫组织化学和分子遗传学特征。新版中肺神经内分泌肿瘤的病理学诊断标准相比旧版无明显变化,根据核分裂象数及Ki-67增殖指数可对肿瘤进行分类诊断。低级别的典型类癌和中等级别的非典型类癌一般分别对应胰腺神经内分泌肿瘤1级(G1)和2级(G2)。值得注意的是,存在灰区神经内分泌肿瘤的病例,组织学形态类似于非典型类癌,但核分裂象数>10/2mm2和(或)Ki-67增殖指数>30%,且分子遗传学特征更接近于类癌(MEN1突变),而不同于大细胞神经内分泌癌/小细胞癌(TP53、RB1共突变)。该类灰区病例常出现在转移灶中,而肺原发灶极为罕见,按目前的诊断标准应纳入大细胞神经内分泌癌的诊断,但其预后却不同于经典的大细胞神经内分泌癌。由于该类灰区病例尚待更多的研究证实,建议诊断灰区神经内分泌肿瘤时应对其组织形态学进行描述,并记录Ki-67增殖指数及核分裂象数。DAXX/ATRX蛋白缺失有助于胰腺神经内分泌肿瘤的诊断,但在肺类癌的诊断中没有意义。由于类癌的分级诊断需要对肺原发肿瘤切除后的完整评估,所以在小活检标本、转移瘤标本和切除肿瘤未提供完整肿瘤切片标本中,应使用“类癌,非特指型”的诊断术语。在小或挤压的活检标本中,Ki-67增殖指数有助于区分类癌与高级别神经内分泌癌,而当无法区分时,可使用“神经内分泌癌,非特指型”的诊断术语,但应尽可能少使用。新版中增加了肺神经内分泌肿瘤的分子分型,其中肺类癌根据基因突变、基因表达、CpG小细胞癌根据不同的基因表达及甲基化状态,分为ASCL1型、NEUROD1型、POU2F3及YAP1型。
临床前研究[4]显示,不同分子分型可采用不同的治疗方式。大细胞神经内分泌癌主要分为小细胞肺癌(small cell lung cancer,SCLC)-like型和NSCLC-like型。研究[5]显示,SCLC-like型大细胞神经内分泌癌可以从EP方案治疗中获益,但敏感性仍然差于经典SCLC。总体上,大细胞神经内分泌癌治疗效果差,仍期待更佳的治疗方案。
间叶性肿瘤及异位肿瘤
新版中对间叶性肿瘤及异位肿瘤目录中部分肿瘤的位置进行了调整,如旧版中肺间叶性肿瘤目录下的炎性肌成纤维细胞瘤和滑膜肉瘤,新版中均归入胸部间叶性肿瘤章节;旧版中肺间叶性肿瘤目录下的肌上皮瘤/肌上皮癌,新版中归入肺原发涎腺肿瘤;异位肿瘤中删除了旧版中的生殖细胞肿瘤和肺内胸腺瘤。
附注:新版非黏液性微浸润腺癌的ICD-O编码未发生改变(ICD-O:8250/3),2015版WHO第1次印刷中误印为8250/2,后续已在2015版WHO第2次印刷及相关参考文献[6]内进行了勘误。
参考文献
1. WHO Classification of Tumours Editorial Board. WHO classification of tumours. Thoracic Tumours[M]. 5th ed. Lyon: IARC Press, 2021.
2. WILLIAM D T, ELISABETH B, ALLEN P B, et al. WHOclassification of tumours of the lung, pleura, thymus and heart (4th edition)[M]. IARC:Lyon, 2015: 1-151.
3. GOLDSTRAW P, CHANSKY K, CROWLEY J, et al. TheIASLC lung cancer staging project: proposals for revision of the TNM stage groupings in the forthcoming (eighth) edition of the TNM classification for lung cancer[J]. J Thorac Oncol, 2016, 11(1): 39-51.
4. GEORGE J, LIM J S, JANG S J, et al. Comprehensive genomic profiles of small cell lung cancer[J]. Nature, 2015, 524(7563): 47-53.
5. REKHTMAN N, PIETANZA M C, HELLMANN M D, etal. Next-generation sequencing of pulmonary large cell neuroendocrine carcinoma reveals small cell carcinoma-like and non-small cell carcinoma-like subset[J]. Clin Cancer Res, 2016, 22(14): 3618-3629.
6. TRAVIS W D, BRAMBILLA E, NICHOLSON A G, et al. The2015 World Health Organization classification of lung tumors: impact of genetic, clinical and radiologic advances since the 2004 classification[J]. J Thorac Oncol, 2015, 10(9): 1243-1260.
不感兴趣
看过了
取消






文章评论(0)