α羟丁酸脱氢酶(羟丁酶脱氢酶)
三羧酸循环的第四步是α-酮戊二酸氧化脱羧,生成琥珀酰辅酶A,由α-酮戊二酸脱氢酶复合体(alpha-ketoglutarate dehydrogenase complex,A-KGDH或2-oxoglutarate dehydrogenase complex,OGDC)催化。这是第二次氧化脱羧,生成NADH。
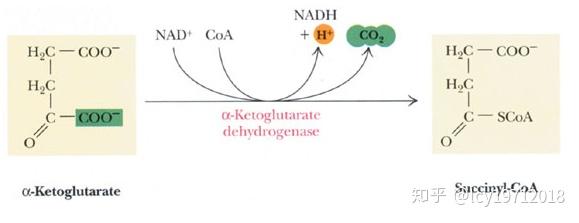
α-酮戊二酸脱氢反应
KGDH与PDH同属于一个家族(2-氧代酸脱氢酶复合体家族),所以催化机制与PDH很相似,E1为α-酮戊二酸脱氢酶,E2为二氢硫辛酰胺琥珀酰转移酶,E3为二氢硫辛酰胺脱氢酶。
KGDH不仅调控三羧酸循环的流量,而且与细胞的氧化应激有关。KGDH催化过程中会产生活性氧,而且在NAD缺乏时会增多。活性氧会抑制顺乌头酸酶和KGDH活性,对三羧酸循环再氧化应激条件下的调控有重要作用(Philos Trans R Soc Lond B Biol Sci. 2005)。
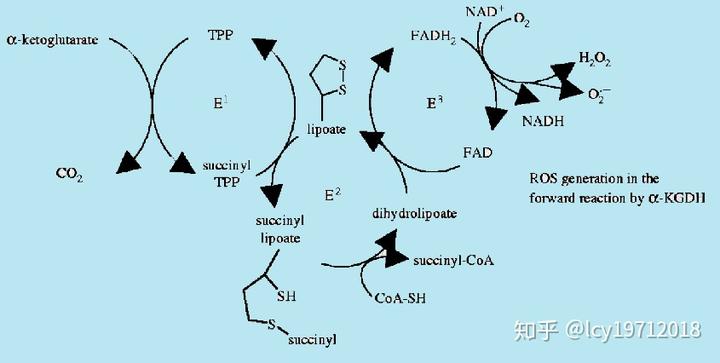
KGDH产生活性氧,引自Philos Trans R Soc Lond B Biol Sci. 2005
第五步是三羧酸循环中唯一一次底物水平磷酸化,由琥珀酰辅酶A合成酶(succinyl-CoA synthetase,也称为琥珀酰硫激酶)催化,生成琥珀酸和GTP。注意它属于连接酶(EC6)。这个反应是可逆的,也可以用来合成琥珀酰辅酶A。后者与血红素合成、酮体代谢等有关。
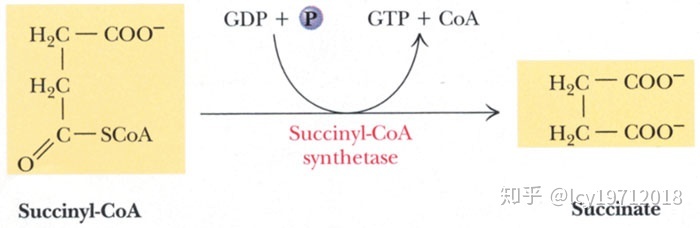
琥珀酰辅酶A的分解
琥珀酰辅酶A合成酶也有生成ATP的类型,在脑中表达较多,与脑线粒体DNA的合成与修复等有关。这种酶的突变会导致线粒体DNA耗竭,造成线粒体脑病(Eur J Hum Genet. 2015)
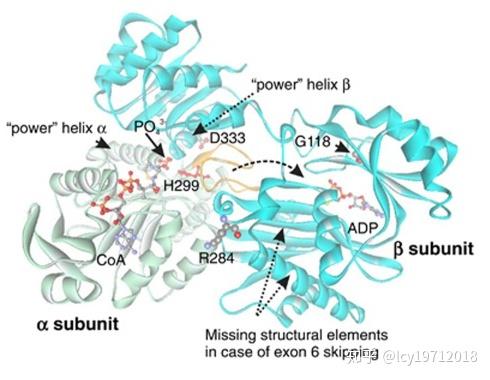
琥珀酰辅酶A合成酶突变体结构模型,引自Eur J Hum Genet. 2015
第六步由琥珀酸脱氢酶(succinate dehydrogenase,SDH)催化,生成延胡索酸(fumaric acid,富马酸)和FADH2。
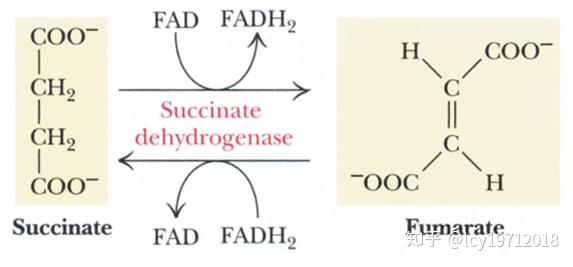
琥珀酸的氧化
琥珀酸脱氢酶位于线粒体内膜(IMM),同时也是呼吸链的组成部分(复合体II)。所以它将三羧酸循环与呼吸链连接起来,生成的FADH2不与酶解离,直接把电子电子用于还原辅酶Q,然后再传递到复合物III。

猪琥珀酸脱氢酶定位于线粒体内膜。引自Crit Rev Biochem Mol Biol. 2015
因为琥珀酸通过琥珀酸脱氢酶与呼吸链相连,所以琥珀酸与延胡索酸的比值反映了线粒体的氧化还原状态。线粒体膜上的二羧酸盐载体SLC25A10可以运载琥珀酸和苹果酸过膜,使线粒体琥珀酸池与细胞质中的快速平衡。这就提供了一个表示线粒体状态的信号。所以琥珀酸可以作为一种信号分子,调控细胞的氧化应激和炎症反应。顺乌头酸也有类似作用(Cell. 2018)。

琥珀酸和顺乌头酸参与炎症反应调控,引自Cell. 2018
SDH的突变会导致多种人类疾病,主要是肿瘤和神经退行性疾病(Crit Rev Biochem Mol Biol. 2015)。
第七步是延胡索酸水化,由延胡索酸酶(fumarase)催化。这是一个反式加成反应,只生成L-苹果酸。
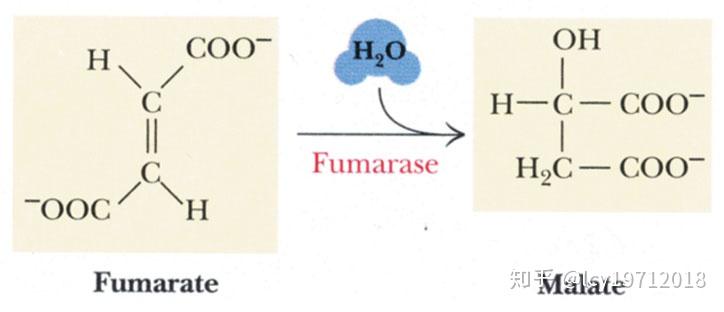
延胡索酸水化反应
大多数真核生物的延胡索酸酶在细胞质中也有分布。这种双重定位称为“回声形式”,但不同生物的具体形成机制有所不同。
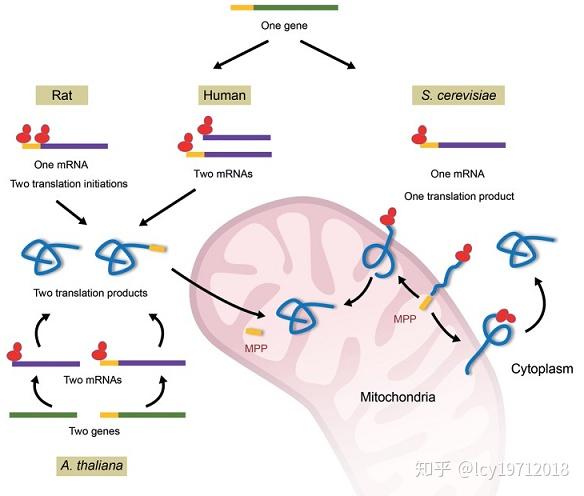
不同生物体延胡索酸酶的双重定位机制,引自Front Mol Biosci. 2018
细胞质中的延胡索酸酶在细胞发生DNA双链断裂(DSB)时会进入细胞核,催化苹果酸生成延胡索酸,参与调控修复过程(Front Mol Biosci. 2018)。
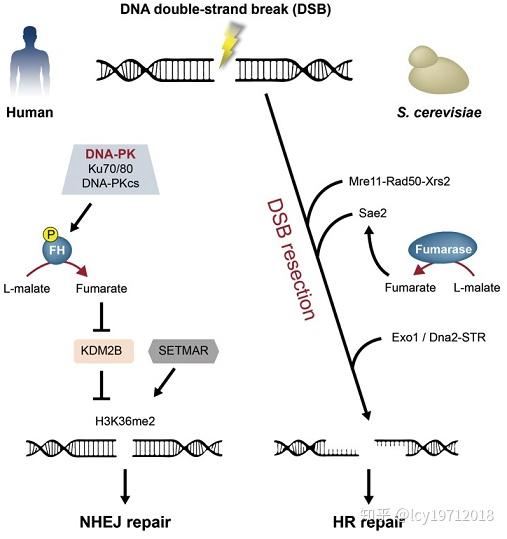
延胡索酸酶参与细胞核中的DNA修复过程,引自Front Mol Biosci. 2018
参考文献:
Laszlo Tretter, Vera Adam-Vizi. Alpha-ketoglutarate dehydrogenase: a target and generator of oxidative stress. Philos Trans R Soc Lond B Biol Sci. 2005 Dec 29;360(1464):2335-45.Sanna Matilainen, et al. Mitochondrial encephalomyopathy and retinoblastoma explained by compound heterozygosity of SUCLA2 point mutation and 13q14 deletion. Eur J Hum Genet. 2015 Mar;23(3):325-330.Jonathan G Van Vranken, et al. Protein-mediated assembly of succinate dehydrogenase and its cofactors. Crit Rev Biochem Mol Biol. Mar-Apr 2015;50(2):168-80.Michael P Murphy, Luke A J O'Neill. Krebs Cycle Reimagined: The Emerging Roles of Succinate and Itaconate as Signal Transducers. Cell. 2018 Aug 9;174(4):780-784.Michael Leshets, et al. Fumarase: From the TCA Cycle to DNA Damage Response and Tumor Suppression. Front Mol Biosci. 2018 Jul 25;5:68.






文章评论(0)