超能特战队(超能鹿战队减脂餐)

当前,CAR-T疗法无疑是肿瘤免疫治疗的“新贵”。
CAR-T疗法全称为嵌合抗原受体T细胞免疫疗法,作为免疫军团中的“超能特战队”,CAR-T疗法与常规的小分子或生物疗法不同,它主要是将患者血液中的T细胞提取出来,经过改造后表达嵌合抗原受体,从而识别并攻击表达特定抗原的肿瘤细胞。
说得再形象点,CAR-T疗法就是给T细胞装上了GPS导航系统,使其能够直接识别出癌细胞,并进行杀伤。
事实上,作为一项“新技术”,CAR-T疗法从概念提出到第一款产品上市,时间跨度不到30年。上世纪90年代,以色列免疫学家Zelig Eshhar教授提出了CAR-T的概念;2011年,美国宾夕法尼亚大学Carl June教授用靶向CD19的CAR-T在临床上治愈了2例复发难治性B淋巴细胞白血病患者。
2017年,美国FDA批准全球首款CAR-T产品上市;2021年,中国NMPA也批准了两款CAR-T上市;2022年2月,南京传奇生物的CAR-T产品cital-cel成功在美国上市销售。
虽然上市时间短,但CAR-T疗法却在市场中展现出了很好的适用性。据数据统计,2021年,全球CAR-T产品销售额17.1亿美元,2022年上半年,CAR-T产品销售额已达12亿美元,上升势头明显。
在这样一个火热且充满无限可能的新赛道,必然会迸发出很多新的想法,徐州医科大学王刚教授的全人源B7H3 CAR-T疗法就是其中之一。据悉,该疗法已自主筛选获得了靶向人B7H3的全人源scFv序列,并以其为基础构建了CAR-T/NK/iNKT等免疫细胞治疗技术。
近日,受2022年第二届生物医学领域高价值专利项目评选活动邀请,徐州医科大学郑骏年教授免疫细胞治疗团队骨干王刚教授就科研成果以及后续转化,与动脉橙果局进行了一次深度对话。
#01
千万亿市场呈空缺状态
攻坚实体瘤,CAR-T疗法道阻且长。
“至今,CAR-T技术在市面上,已经有8款药物,包括了在美国上市的6款药和在中国上市的2款药,但美中不足的是,这些已经上市的药物全部是针对血液系统肿瘤。”
王刚在采访中谈道,不管是国内还是国外,CAR-T的商业化进展一直备受关注。虽然CAR-T细胞这种创新型免疫疗法已被证实在血液系统恶性肿瘤取得显著疗效,但实体瘤一直是横亘在CAR-T细胞疗法面前的一大阻碍。
从市面上来看,实体瘤CAR-T目前尚无产品获批,而从研发进度上,我们也了解到,实体瘤CAR-T的研发进度最快的仍处于II期临床阶段,即使在一些针对间皮瘤、肉瘤、胃癌和胰腺的小型研究中,CAR-T疗法显示出较好的安全性,但在临床疗效上,完全无法与血液肿瘤匹敌。
实体瘤CAR-T疗法仍然面临多重挑战:
第一是缺乏有效靶点,在临床试验中使用的多为肿瘤相关抗原(TAA),但TAA在部分正常组织中也有表达,这给CAR-T细胞疗法带来了脱靶风险和安全性问题。
第二是实体瘤异质性强,在不同患者个体间或者同一患者体内不同部位肿瘤细胞间在免疫特性、生长速度、侵袭能力等方面也存在显著差异,这导致同一款CAR-T只能杀死部分实体瘤细胞,而残存的肿瘤细胞继续增殖转移。
第三是肿瘤微环境的免疫抑制明显,抑制性的免疫细胞和抑制性的细胞因子,都会抑制进入肿瘤内部的CAR-T细胞活性。此外,肿瘤细胞还通过抗原缺失、共刺激信号异常以及表达免疫检查点分子来影响CAR-T细胞抗肿瘤活性,导致TME中的免疫耐受。
“实体肿瘤CAR-T疗法的市场规模可以达到千亿甚至万亿这个级别。”但因其市场需求大和技术壁垒高,直到现在,实体肿瘤CAR-T技术还处于一片市场蓝海之中。
那如何成为“第一个吃到螃蟹的人”?王刚教授的答案是以技术为敲门砖。
#02
攻破技术难点,已有治疗病例
基于当前研究难点,王刚教授的“全人源B7H3 CAR-T疗法”自项目启动开始,就设立了两个核心目标。
第一是解决鼠源scFv的免疫原性诱发HAMA问题,最大程度降低CAR-T细胞免疫原性,避免回输后被机体免疫排斥;第二是开发通用型iNKT底盘细胞,一方面利用其自身特点有效杀伤肿瘤微环境内的TAM和MDSC等免疫抑制细胞,来增强抗肿瘤免疫,另一方面利用其天然通用性优势开发现货型CAR-iNKT细胞产品。
有了方向,王刚团队便开始针对实体瘤开发B7H3靶点,自主筛选获得了靶向人B7H3的全人源scFv序列,并以其为基础构建了CAR-T/NK/iNKT细胞等免疫细胞治疗技术。
此外,团队还自主开发了人iNKT细胞体外诱导扩增体系,iNKT纯度超过99%,体外扩增超过2000倍,以其为底盘细胞开发通用型免疫细胞治疗技术;此外,他们还开发了增效型CAR-NK免疫细胞制备技术。目前,均已在多种肿瘤模型中完成了功能验证。
当然,要取得这样的成绩并不是容易的事,在研究过程中,王刚团队也碰到过种种困难。王刚告诉动脉橙果局,团队从2015年开始就专注于探索性临床研究,最早同样也是针对鼠源进行分析,但在进入临床试验后,其肿瘤复发率太高,效果并不尽如人意。
为了走出这一困境,团队开始尝试构建一个全人源scFv展示文库。在文库中,团队经过四轮筛选,幸运地找到了能够靶向识别并结合人B7H3抗原的抗体序列,再经过一系列的反复验证后,团队证实用其制备的CAR-T细胞能够很好地靶向杀伤肿瘤细胞。
而当提及技术的核心优势时,王刚也同样娓娓道来,目前上市的8款药品都是源于鼠源/羊驼抗体,而团队技术的关键在于全人源,即所有氨基酸序列都来源于人体。
实际上,不同物种之间,之所以难以进行器官或肢体移植,一个重要的原因就是难以有效避免排异反应。在抗体疗法中也同样如此,鼠源抗体被人体免疫系统识别,引起人抗鼠抗体反应,使得单抗药物疗效减弱,并引起严重的不良反应。
这在一定程度上,也解释了CAR-T治疗的复发率特别高的原因,而采用全人源scFv则能使CAR-T的免疫原性降到最低,免疫细胞在体内的存活时间可能会延长,最终提高治疗效果。
当然,这样的技术优势也得到了验证。
先是在模型验证中的突破,据了解,以靶向人B7H3的全人源scFv序列为基础构建的CAR-T/NK/iNKT细胞已经在卵巢癌、肝癌、肺癌、肾癌、前列腺癌等10余种肿瘤细胞模型中完成了杀瘤效果验证;并在人卵巢癌、肺癌、肾癌、前列腺癌、胰腺癌、脑胶质瘤等小鼠移植瘤模型中完成了有效性验证。
再是在真实案例中的成功,王刚透露,“目前,技术已经申请探索性临床试验伦理批件6项,并完成卵巢癌、前列腺癌、肝癌等患者治疗6例。”在这些病例中,已经初步验证了其安全性,并观察到抑瘤效果,临床疗效仍在持续观察中。
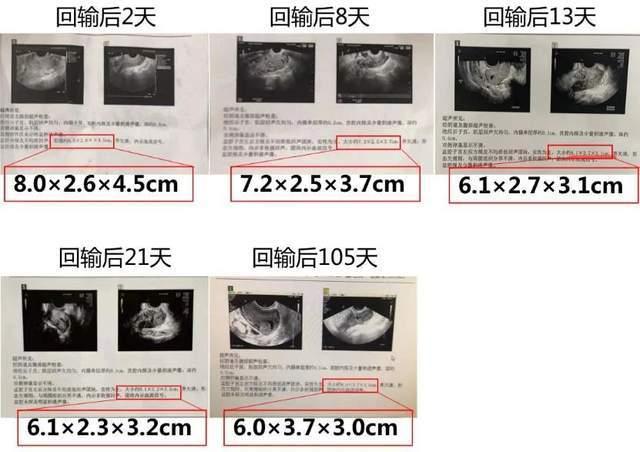
图:B7H3 CAR-T治疗晚期卵巢癌首例患者检测结果
#03
找融资是转化难点,也是“重头戏”







文章评论(0)