亨廷顿舞蹈症(亨廷顿舞蹈症临床表现)
系统性硬化(SSc)、皮肌炎(DM)
Corbus与Kaken公司合作开发和商业化Lenabasum以治疗系统性硬化和皮肌炎

Corbus Pharmaceuticals Holdings公司近日宣布与Kaken Pharmaceutical公司建立战略合作,在日本开发和商业化研究性药物lenabasum,以治疗罕见而严重的自身免疫性疾病——系统性硬化(systemic sclerosis,SSc)和皮肌炎(dermatomyositis,DM)。
根据协议条款,Kaken公司将获得在日本商业化和营销lenabasum的独家许可。Kaken公司将向Corbus公司预付2700万美元。在实现一定的监管、开发和销售里程碑后,Corbus公司将有资格获得另外1.73亿美元以及两位数的提成。
迄今为止的临床研究表明,Lenabasum具有良好的安全性和耐受性。在治疗弥漫皮肤性SSc和皮肤为主DM患者的2期研究中,Lenabasum改善了多个医生评估和患者报告的有效性结果。在2期囊性纤维化研究中,Lenabasum也减少了肺恶化。目前正在进行和/或计划进行更多的临床研究,以确认这些结果并支持申请监管批准。
亨廷顿舞蹈症(HD)
大部分移植的胎儿神经细胞在亨廷顿舞蹈症患者大脑中发育不良
一项最近发表于《神经病学年鉴》(Annals of Neurology)的研究发现,虽然移植的胎儿神经细胞可以在亨廷顿舞蹈症(Huntington’s disease,HD)患者大脑中长期存活,但只有一种被称为中间神经元的特定子群能够茁壮成长。
作者们表示,可能由于炎症反应,投射神经元——HD中通常丢失的神经细胞——很少被检测到。将胎儿神经细胞移植到大脑作为HD潜在治疗策略始于20多年前,这些细胞可以在培养基中扩增和维护作为干细胞或分化成各种类型的神经细胞。
全球范围内已经进行了7项小的神经移植非盲试验,评估该疗法治疗HD患者的的安全性、耐受性及其可行性。在当前的新研究中,研究人员介绍了对NEST-UK多中心试验(ISRCTN36485475)所招募5名轻度HD患者中一人的脑组织分析结果,这些患者被移植了来自胎儿纹状体(大脑中负责运动协调的区域)的细胞。
骨髓纤维化
CTI公司提供Pacritinib治疗骨髓纤维化开发项目的更新
图片:CTI BioPharma Corp.
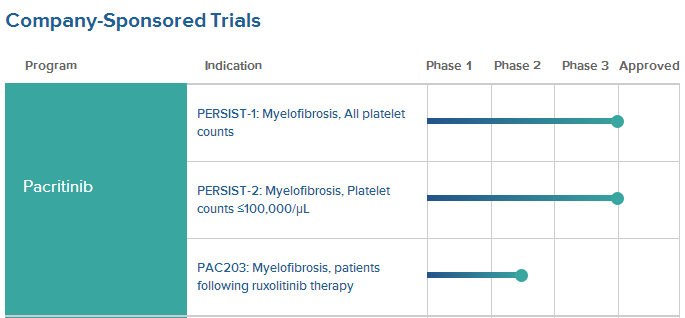
CTI BioPharma公司近日宣布:在最近的一次C型会议上获得美国食品与药物管理局(FDA)的监管反馈,涉及pacritinib治疗伴严重血小板减少症(thrombocytopenia,血小板计数不到50000每微升)骨髓纤维化(myelofibrosis,原发性骨髓纤维化、真性红细胞增多症后骨髓纤维化或原发性血小板增多症后骨髓纤维化)成人患者随机、3期研究试验设计的关键要素。
计划的3期研究旨在评估pacritinib与医生选择的治疗方案相比较的效果。主要有效性终点为基线至第24周期间脾脏体积缩小(SVR)35%及以上的患者比例。次要有效性终点包括总症状评分下降和总生存期。
在开始该3期研究前,CTI公司计划与FDA会晤以讨论PAC203 2期研究的最终最优剂量分析。为了加速过渡到3期研究,CTI公司打算修改PAC203方案以包括3期要素。PAC203 3期研究部分设计为招募大约200名患者,预计将于2019年第三季度开始招募。
巴腾病(Batten disease)
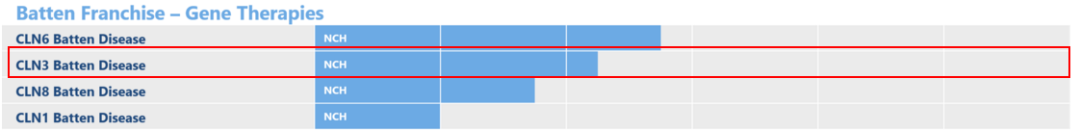
Amicus公司宣布启动AAV9-CLN3基因疗法治疗巴腾病的1/2期研究
图片:Amicus Therapeutics
Amicus Therapeutics公司近日宣布启动一项1/2期临床研究,评估血清9型腺相关病毒AAV9-CLN3基因疗法治疗儿童CLN3型巴腾病(Batten disease)的安全性和有效性。初始患者给药后完成了一个月的观察期,目前为止没有报告严重的不良事件。
这是研究性基因疗法治疗CLN3型巴腾病的首个人类研究,目前正在俄亥俄州哥伦布市的全国儿童医院(Nationwide Children 's Hospital)进行。
巴腾病是一类广泛的罕见、致命、遗传性神经系统疾病(也被称为神经类蜡样脂褐变,NCLs)的统称,目前已知有13种形式,通常被称为CLN1-8;10-14。不同类型巴腾病的特征和症状相似,但严重程度和发病年龄有所不同。大多数形式的巴腾病通常开始于儿童期。
神经节苷脂沉积症
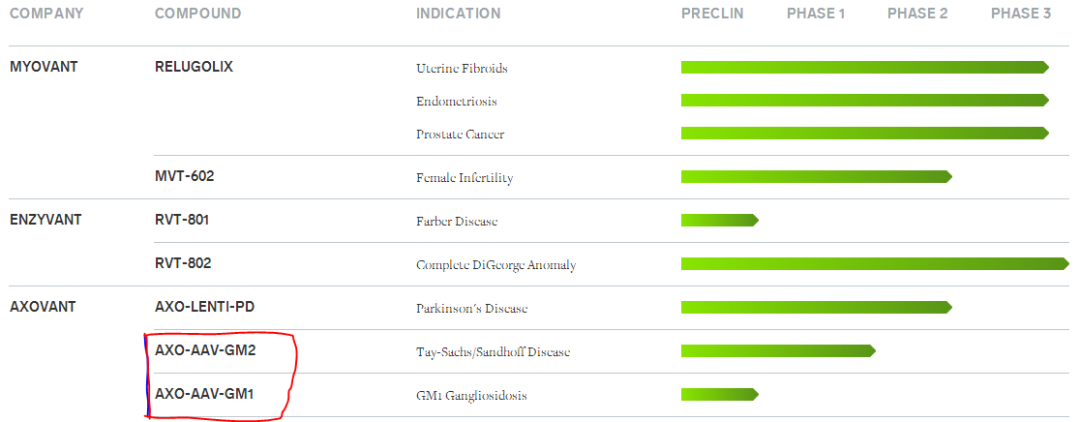
Axovant公司获得GM1和GM2神经节苷脂沉积症研究性基因疗法的全球独家许可
图片:Axovant Sciences
Axovant Sciences公司近日宣布:获得麻省大学医学院开发和商业化两个新型基因疗法项目的全球独家许可,以治疗GM1神经节苷脂沉积症(GM1 gangliosidosis)和GM2神经节苷脂沉积症(GM2 Gangliosidosis,也被称为泰-萨克斯和桑德霍夫病)。
GM1和GM2神经节苷脂沉积症是两种进展迅速的致命小儿溶酶体贮积症,严重形式患者预期寿命短至2-4岁以下,全球发病率分别约为1/100000和1/180000活产儿。GM1神经节苷脂沉积症由GLB1基因缺陷引发,GM2神经节苷脂沉积症由HEXA(导致泰-萨克斯病)和HEXB(导致泰-萨克斯病)基因缺陷引发,造成酶功能受损和毒性神经节苷脂主要在中枢神经系统中积聚。
AXO-AAV-GM1和AXO-AAV-GM2分别被设计为引入各自相关基因的功能拷贝,目的是提高生存期,使患儿达到关键的发育里程碑。AXO-AAV-GM1将在美国国立卫生研究院(NIH)的一个由研究人员发起的临床项目中进行评估,预计将在2019年上半年治疗首名患者。AXO-AAV-GM2临床项目正在进行之中,首名受试者已经接受治疗。
IgA肾 (IgAN)
Sparsentan治疗IgA肾病的3期PROTECT研究完成首名患者给药
Retrophin公司近日宣布:评估sparsentan治疗IgA肾病(IgA nephropathy,IgAN)长期肾脏保护潜力的关键PROTECT研究完成对首名患者的治疗。
PROTECT研究是一项全球性、随机、多中心、双盲、并行臂、对照3期临床试验,评估sparsentan治疗IgAN的安全性和有效性。将招募大约280名18岁以上的患者。
IgAN也被称为Berger病(Berger’s disease),是一种罕见的慢性肾病,据估计20-40%的患者会在确诊后10-20年内发展为终末期肾病(ESRD)。IgAN经常表现为进行性蛋白尿、血尿和急性肾病综合征。
重症肌无力(MG)
Catalyst公司发表Firdapse®治疗重症肌无力2b期研究临床数据
图片:.
Catalyst Pharmaceuticals公司近日宣布:由研究人员发起评估Firdapse®(amifampridine phosphate)治疗MuSK抗体阳性重症肌无力(MuSK antibody positive Myasthenia Gravis,MuSK-MG)的2b期临床试验(MSK-001)结果在线发表于《SAGE Open Medicine》,标题为:“Amifampridine phosphate治疗肌肉特异性激酶重症肌无力:一项2b期、随机、双盲、安慰剂对照、双交叉研究”。这项研究是在Silvia Bonanno博士和她在意大利米兰卡洛贝斯塔神经学研究所团队的指导下进行的。
“该先导研究的结果非常令人鼓舞,我们评估Firdapse治疗MuSK-MG的多中心关键3期试验目前正在进行之中。关键试验是在FDA特别方案评估(SPA)下进行的,”Catalyst公司首席医疗官Gary Ingenito博士说道。
糖原贮积症
Ultragenyx公司公布DTX401基因疗法治疗Ia型糖原贮积症1/2期临床研究的积极结果
图片:Ultragenyx Pharmaceutical
Ultragenyx Pharmaceutical公司近日宣布了来自DTX401治疗Ia型糖原贮积症(glycogen storage disease type Ia,GSDIa)1/2期研究首个、最低剂量组的积极的顶线安全性和有效性数据。在全部3名患者中均观察到一种生物反应,表现为空腹血糖控制改善和空腹发生低血糖前的时间延长,其中两名患者在对照的空腹挑战过程中表现出低血糖前时间方面有临床意义的改善。
GSDIa是最常见的遗传性糖原贮积症。该病由编码G6Pase-α酶的基因缺陷导致,造成无法调节血糖。GSDIa患者的低血糖可能危及生命,而某些器官和组织中复合糖原的积聚会损害这些组织的正常功能。如果长期不进行治疗,患者会出现严重的乳酸酸中毒,发展为肾衰竭,并可能在婴儿期或儿童期死亡。该病目前没有获批的药物疗法,估计全球范围内有6000名患者。
DTX401是一种基于腺相关病毒(AAV)的基因疗法,单次静脉给药在临床前研究中表现出能够改善G6Pase-α活性,减少肝糖原水平。DTX401已经获得美国和欧洲的孤儿药资格认定。
多囊性肾病
Reata公司宣布甲基巴多索隆治疗多囊性肾病的3期FALCON试验设计
Reata Pharmaceuticals公司近日宣布:成功完成与FDA关于甲基巴多索隆(bardoxolone)治疗常染色体显性多囊性肾病(autosomal dominant polycystic kidney disease,ADPKD)患者3期临床试验设计的2期结束会议。这项名为FALCON的试验将是一项国际性、双盲、安慰剂对照、并行组、3期试验。公司计划招募约300名年龄18-70岁、肾小球滤过率(eGFR)为30-90 mL/min/1.73 m2的ADPKD患者,1:1随机分配接受每日一次口服巴多索隆或安慰剂治疗。
巴多索隆是一种实验性、口服、每日一次的Nrf2激活因子,Nrf2是一种转录因子,(能够)通过恢复线粒体功能、减少氧化应激和抑制促炎信号来促进炎症的解决。巴多索隆已经获得FDA授予治疗Alport综合征和肺动脉高压的孤儿药资格认定以及欧盟委员会(EC)授予治疗Alport综合征的孤儿药资格认定。除了FALCON试验,巴多索隆目前还在进行治疗Alport综合征所致慢性肾病(CKD)的3期CARDINAL研究、治疗肺动脉高血压相关结缔组织疾病的3期CATALYST研究、治疗糖尿病肾病的3期AYAME研究,以及治疗ADPKD、IgA肾病、局灶性节段性肾小球硬化和1型糖尿病相关CKD的2期PHOENIX研究。
10
埃勒斯-当洛斯综合征(vEDs)
FDA接受EDSIVO™治疗埃勒斯-当洛斯综合征的新药上市申请并优先审查

图片:Acer Therapeutics
Acer Therapeutics Inc公司近日宣布:FDA接受EDSIVO™治疗确认携带III型胶原蛋白(COL3A1)突变的血管埃勒斯-当洛斯综合征(vascular Ehlers-Danlos syndrome,vEDS)患者的新药上市申请(NDA)。FDA还授予该NDA优先审查,并将2019年6月25日定为处方药使用者收费法案(PDUFA)目标行动日期。优先审查是FDA授予的一项资格认定,用于加快药物的审查过程,所授予的是那些能够提供显著治疗改善的药物,或者用于治疗目前没有满意疗法的疾病的药物。
EDS是一组结缔组织遗传病,vEDS是其中最严重的亚型,患者会遭受危及生命的动脉剥离和破裂,以及肠道和子宫破裂。目前还没有获得FDA批准的vEDS疗法。基于一项随机对照临床研究,Acer公司正在推进EDSIVO™(celiprolol)用于治疗vEDS。2015年,EDSIVO™获得FDA授予治疗vEDS的孤儿药资格认定。







文章评论(0)