法布里病(法布里病fabry病)
每年2月份的最后一天是“国际罕见病日”。一场突如其来的新冠肺炎疫情打乱了社会的运转秩序,前阵子几乎举国上下的医疗力量都聚焦在攻克新冠疫情方面。罕见病患者们面临着购药困难或者无法到定点医院就医的情况。
笔者对罕见性疾病及相关药物开发的认知起源于2014年。随着时间推移,愈发感觉到来自公益、商业、政策等多方面的“向善”力量,是推动罕见病药物开发的源泉。
从公益出发
说起罕见性疾病的公益活动,最为有名的非“冰桶挑战”莫属。这是2014年由美国波士顿学院前棒球选手发起的一项关注“肌肉萎缩性侧索硬化症(ALS)”患者的社交活动。该活动要求参与者在24小时内接受挑战在网络上发布自己被冰水浇遍全身的照片(视频),否则就选择为对抗“肌肉萎缩性侧索硬化症”捐出100美元,也可以两者都做,完成后还可指定3名挑战者。
正是通过这项活动,让公众对ALS这一疾病有了较为深刻的认知。ALS是四大常见的神经退行性疾病之一,斯蒂芬·威廉·霍金(Stephen WilliamHawking)从21岁就开始罹患该疾病。
霍金于2018年3月14日去世,然而在他同ALS斗争的55年间,全球仅有2款可用于ALS适应症的药物上市,分别是Covis Pharma的谷氨酸释放抑制剂利鲁唑(Riluzole),Mitsubishi Tanabe Pharma的自由基清除剂依达拉奉(Radicava)。
中国在罕见病领域奔波的公益使者,最有名的莫过于自身罹患“成骨不全症”、江湖人称“一米老大”的黄如方先生。他于2008年创立了公益组织“瓷娃娃罕见病关爱中心”,倡导全社会加强对成骨不全症患者的关爱和救助。2013年,黄如方与同事一起成立了“罕见病发展中心”(CORD),现更名为“蔻德罕见病中心”。
笔者从蔻德罕见病中心官方微信号上获悉,该中心在新冠疫情发生期间根据疾病分类对外发布了多批受疫情影响的患者家庭求助信息,身体力行地为有需要的罕见病患者提供药品信息及服务,让他们在疫情期间用上药物,接受治疗。
从商业出发
有人说,商业是最大的慈善,最好的商业一定是最大的公益。医药圈内的很多同仁都看过《良医妙药》(Extraordinary Measures)这部电影。该故事的主人翁原型是生物科技公司Amicus Therapeutics的创始人John Crowley。
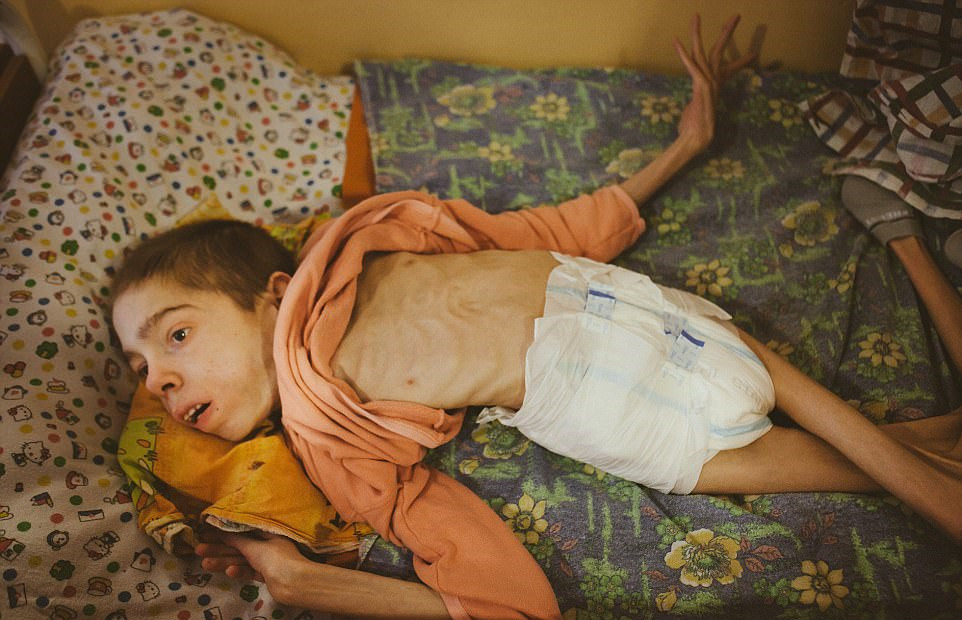
John Crowley的一双儿女患有一种叫做“庞贝氏症”的罕见性疾病。该疾病的成因是第17对染色体出现病变,导致体内缺乏酸性α-葡萄糖苷酶这种酵素,而无法分解肝醣,会导致肌肉无力,心脏扩大等病因,可分成婴儿型及晚发型两种,刚出生的婴儿若得此病症,通常活不过1~2岁。
John Crowley创立的第一家公司Novazym参与了全球首个治疗庞培氏症(Pompe)的药物Myozyme(alglucosidasealfa, rhGAA)的早期开发,并在2001年被健赞公司以1.375亿元收购。

Amicus Therapeutics在研产品管线。来源:公司官网
卖掉公司后,John Crowley没有停止在罕见病药物开发领域的探索,随后他又创立了Amicus。从该公司在研产品管线不难发现,法布里病、庞贝氏症、贝敦氏病等罕见性疾病是其主攻的适应症。2019年2月,Amicus与药明生物就新一代庞贝氏症疗法ATB200达成独家商业化生产战略合作,该药物已被FDA授予突破性疗法认定。
John Crowley在罕见病药物开发领域的坚持不懈,离不开美国对罕见病药物开发的支持。在美国,用于治疗罕见疾病的药物被称作“孤儿药(Orphan Drug)”。FDA规定:患病人数少于20万人就符合罕见病的定义,从事该类适应症的药物开发可以申请“孤儿药”身份。
在美国,某个新药一旦获得FDA孤儿药身份,将享有税收减免、免申请费、研发资助、加快审批以及上市后7年的市场独占权,甚至还可能获得一张宝贵的优先审评券。因此从新药研发的角度看,以孤儿药身份进入市场,享受市场独占期后再拓展适应症,不失为一种“以奇致胜”的临床开发战略。
这种“弯道超车”的商业模式,使得罕见病虽小,却是一门大生意。《我不是药神》药物原型格列卫,最初就是以“孤儿药”获批,最后成为年销售峰值逼近50亿美元的超级“重磅炸弹”。2019年FDA批准的48款新药中,有21款(44%)新药获得了“孤儿药”称号。
中国虽然在孤儿药领域的开发起步较晚,但不乏追求者。鉴于FDA对罕见病药物开发的支持力度,国内不少创新药企业选择在美国发病率较低的适应症,向FDA申报“孤儿药资格认定”,采取中美双报的开发策略,不失为一种商业模式。一旦成功,既造福了相应的罕见病群体,也加快了产品的开发进程。
比如就在霍金去世的前三天(2019年3月11日),石药集团开发的药物「丁苯酞」获得FDA颁发就治疗ALS的“孤儿药资格认定”。截止到目前,我国共有30多个药物被FDA授予“孤儿药”称号。
从政策出发
关于罕见病药物的支付方式,是一个社会学问题。某个罕见病药物究竟该不该纳入医保,社会上存在不同的声音。当前政府承担孤儿药相关政策制定及医保支付的作用,涉及的主要部门包括医保(医保支付)、卫健委(目录制定、患者登记、医疗机构管理)与药监(药品注册审评)。
尽管国内目前尚无官方版的罕见病及孤儿药定义,但民间机构对“罕见病”有一定的定义。早在2016年9月由罕见病发展中心与树兰医疗联合主办的第五届中国罕见病高峰论坛上,就发布了民间版《中国罕见病参考名录》,共定义了147种罕见病。
不过近年来,国家推出了一系列政策激励罕见病研究和孤儿药研发。2018年5月,国家卫生健康委员会等五部委联合制定了《第一批罕见病目录》,首次以官方名义公布了121种罕见性疾病。
2019年,国家卫生健康委组织罕见病诊疗与保障专家委员会办公室(中国医学科学院北京协和医院)牵头制定了《罕见病诊疗指南(2019年版)》,为疾病诊疗规范、药物政策、医保救助政策等相关工作提供了有效的参考和依据。
此外,创新36条(国务院《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》)中对于罕见病目录制定、患者管理登记、减免临床、附带条件批准上市等做了明确规定,使得部分药品以罕见病用药的身份,进入优先审评审批名单。
结语
罕见性疾病多数是因基因突变导致的遗传性疾病,甚至有一种说法是“罕见病患者为正常人承担了那0.001‰的基因突变”。让罕见病患者有尊严的活着,绝不是依靠一个人、一家公司、一个部门所能解决的。
今年国际罕见病日的主题是“We are the 300 million”,译为“全球三亿,从不罕见”。或许公益、商业和政策的通力合作,能让更多的人关注到罕见病患者,更多的药企加大孤儿药的开发,更多的政策支持罕见病药物的研究和支付。







文章评论(0)